
| A. | 电池工作时,Zn为负极,负极区PH变大 | |
| B. | 电池负极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极流向负极 | |
| D. | 电解质氢氧化钾溶液中阳离子迁移到电池的正极 |
分析 根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),以此解答该题.
解答 解:A、根据总反应可知Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,负极区PH减小,故A错误;
B、根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),故B错误;
C、原电池中,电子由负极经外电路流向正极,故C错误;
D、阳离子向正极移动,故D正确.
故选D.
点评 本题考查化学电源的工作原理,题目难度不大,注意电极反应方程式的书写和判断.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA | |
| B. | 1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | H2S的水溶液中存在下列平衡:H2S?2H++S2- | |
| D. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| C. | 充电过程中阳极反应式为:2NaNiFeIIⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ(CN)6 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| C. | 氢气之所以被称为“绿色能源”是因为它燃烧的产物不会污染环境 | |
| D. | 人类利用的能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有还原性,能与强氧化性的高锰酸钾发生氧化还原反应 | |
| B. | 因为二氧化硫具有漂白性,能使品红溶液永久褪色 | |
| C. | 大气中二氧化碳浓度高时能形成酸雨 | |
| D. | 浓硫酸常用作干燥剂,因为浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8或C5H8 | B. | C3H8或C5H8 | C. | C4H8或C3H8 | D. | C5H8或C6H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
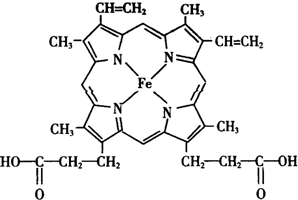 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: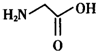 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.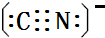 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com