
| A. | NaHCO3溶液与盐酸:CO32-+2 H+═H2O+CO2↑ | |
| B. | 向澄清的石灰水中加入过量的小苏打溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | AlCl3溶液与过量氨水反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
分析 A.碳酸氢根离子不能拆开;
B.小苏打为碳酸氢钠,碳酸氢钠过量,反应生成碳酸钙沉淀、碳酸钠和水;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.氨水为弱碱,无法弱碱氢氧化铝,二者反应生成氢氧化铝沉淀;
解答 解:A.NaHCO3溶液与盐酸生成氯化钠和水,正确的离子方程式为:HCO3-+H+═H2O+CO2↑,故A错误;
B.向澄清的石灰水中加入过量的小苏打溶液,反应生成碳酸钠、碳酸钙沉淀和水,反应的离子方程式为:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故B正确;
C.向硝酸亚铁溶液中加入稀硫酸,二者发生氧化还原反应,正确的离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故C错误;
D.AlCl3溶液与过量氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:解答题
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.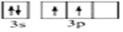 .
.| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++Cu=2Fe2++Cu2+成立说明氧化性:Fe3+>Cu2+ | |
| B. | 25℃,pH=0的溶液中,Al3+、NH4+、NO3-、Fe2+可以大量共存 | |
| C. | 5.6g铁与足量的氯气反应失去电子为0.2mol | |
| D. | 硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、NO3-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Cu2+、Na+、SO42-、OH- | D. | Ba2+、SO32-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入镁粉的质量/克 | 1 | 2 | 3 | 4 | 5 | 6 |
| 生成硫酸镁的质量/克 | 5 | m1 | 15 | 18 | m2 | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.5mol/LMgCl2溶液 | B. | 200mL0.25mol/LCaCl2溶液 | ||
| C. | 50mL1mol/LNaCl 溶液 | D. | 25mL0.5mol/LAlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 恒温恒容装置中发生如下反应:A(g)+2B(g)?2C(g)△H=-a kJ•mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如图所示.下列说法正确是( )
恒温恒容装置中发生如下反应:A(g)+2B(g)?2C(g)△H=-a kJ•mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如图所示.下列说法正确是( )| A. | 反应放出的热量一定小于a kJ | |
| B. | 5s后,反应停止,各物质浓度保持不变 | |
| C. | 5s末,ν(A):ν(B)=1:2 | |
| D. | 阴影部分面积可以表示A的物质的量浓度减少量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com