

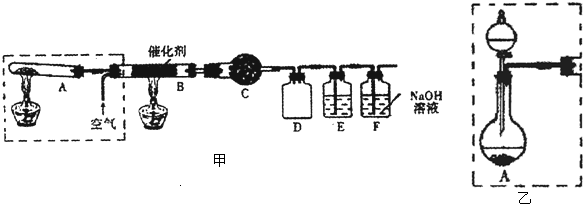
分析 (1)实验室中用下列装置制FeCl3,利用装置A制备氯气,得到氯气中含有水蒸气和氯化氢,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,干燥的氯气通过装置B和铁反应生成氯化铁,剩余氯气通过装置D吸收,防止污染空气;
(2)A中选择:①MnO2 ⑤浓盐酸,加热反应生成氯化锰=氯气和水;装置C是吸收氯气中的水蒸气,用浓硫酸吸收;
(3)铁和氯气反应生成氯化铁,停止反应后,还有Fe丝剩余,将管中物质用水溶解,溶液中铁和氯化铁反应生成氯化亚铁,如果铁量较多,溶液中溶质可能全部为氯化亚铁或氯化亚铁和氯化铁的混合物,如果全部为氯化亚铁,加入KSCN溶液不变红色,若要最终得到FeCl3溶液,要再通氯气,氧化氯化亚铁得到氯化铁溶液.
解答 解:(1)实验室中用下列装置制FeCl3,利用装置A制备氯气,得到氯气中含有水蒸气和氯化氢,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,干燥的氯气通过装置B和铁反应生成氯化铁,剩余氯气通过装置D吸收,防止污染空气,装置连接顺序为:AECBD,
故答案为:A;E;C;B;D;
(2)A中选择:①MnO2 ⑤浓盐酸,加热反应生成氯化锰、氯气和水反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置C是吸收氯气中的水蒸气,用浓硫酸吸收,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓硫酸;
(3)铁和氯气反应生成氯化铁,停止反应后,还有Fe丝剩余,将管中物质用水溶解,溶液中铁和氯化铁反应生成氯化亚铁,溶液中溶质可能全部为氯化亚铁或氯化亚铁和氯化铁的混合物,如果铁量较多,溶质就全部为氯化亚铁,如果全部为氯化亚铁,加入KSCN溶液不变红色,为得到氯化铁溶液,需要最后通入足量的氯气氧化亚铁离子为铁离子,得到氯化铁溶液,
故答案为:不一定;如果铁量较多,溶质就全部为氯化亚铁,则加入KSCN溶液不变红色;通入足量的氯气.
点评 本题考查了实验室制备氯气的反应原理,杂质除杂,物质的制备注意问题和尾气吸收方法,装置连接顺序是解题关键,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,1mol的NH3 | B. | 4℃时,18克水 | ||
| C. | 2mol的Al(密度为2.7g•cm-3) | D. | 常温常压下1mol的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| B. | 28g的乙烯和丙烯中含碳原子数目为NA | |
| C. | 标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成混合气体含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各种物质的量/mol | 达到平衡时体系能量的变化 | |||
| n(A) | n(B) | n(C) | n(D) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
| ② | 0 | 0 | 1 | 4 | 放出热量:Q1 |
| ③ | 1 | 1 | 2 | 1 | 放出热量:Q2 |
| A. | 若容器①中反应10min达到平衡,0~10min时间内,用A表示的平均反应速率v(A)=4.0×10-2mol/(L•min) | |
| B. | 平衡时,①与②容器中A的体积分数相等 | |
| C. | ③达平衡时体系能量的变化主要为热能转化为化学能 | |
| D. | 容器③中,开始时v(B)生成>v(B)消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com