
分析 反应的方程式为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,结合方程式计算.
解答 解:30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,46g乙醇的物质的量为$\frac{46g}{46g/mol}$=1mol,
反应的方程式为CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,由此可知乙醇过量,则
CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
1mol 1mol
0.5mol×67% n
n=0.5mol×67%=0.335mol
m(CH3COOCH2CH3)=0.335mol×88g/mol=29.5g,
答:实际生成乙酸乙酯的质量29.5g.
点评 本题考查化学方程式的计算,题目难度不大,注意反应的理论产率的运用以及反应方程式的书写.


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:推断题
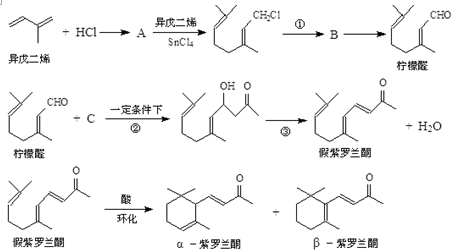
 +Cl2$\stackrel{1,4加成}{→}$
+Cl2$\stackrel{1,4加成}{→}$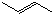
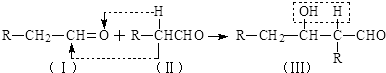
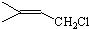 ,C的结构简式
,C的结构简式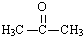 .
.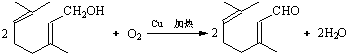 .
.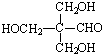 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
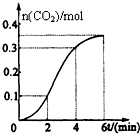 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应2~4分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
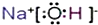 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
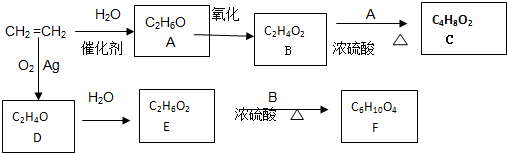
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
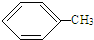 +3HO-NO2$\stackrel{浓硫酸}{→}$
+3HO-NO2$\stackrel{浓硫酸}{→}$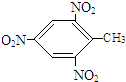 +3H2O.
+3H2O. .
.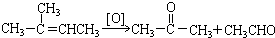
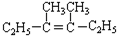 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
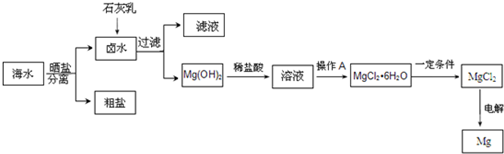
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2、C2H6 | B. | H2O、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、SiC、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 充电电池可以无限制地反复使用 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 废旧电池不能乱扔,需回收处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com