
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
分析 (1)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质,先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据c(Fe3+)=$\frac{Kw(Fe(OH)_{3})}{{c}^{3}(O{H}^{-})}$计算c(Fe3+);
(2)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;
(3)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,根据物质间的关系式进行计算.
解答 解:(1)为得到纯净的CuCl2•2H2O晶体要除去氯化铁,则溶液中的Fe3+转化为Fe(OH)3沉淀,加入物质能与酸反应能转化为氯化铜,且不能引进杂质,可以是Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3;
溶液的pH=4,所以溶液中氢氧根离子浓度为10-4 mol/L,则氢氧根离子浓度为10-10 mol/L,c(Fe3+)=$\frac{Kw(Fe(OH)_{3})}{{c}^{3}(O{H}^{-})}$=$\frac{2.6×1{0}^{-39}}{(1×1{0}^{-10})^{3}}$=2.6×10-9mol/L,
故答案为:Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3;2.6×10-9mol/L;
(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2,反应方程式为:2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解,并带走水蒸气,
故答案为:在干燥的HCl气流中加热脱水;
(3)测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点时溶液蓝色褪去,且半分钟内不变色,
故答案为:淀粉溶液;溶液蓝色褪去,且半分钟内不变色;
②CuCl2溶液与KI反应的离子方程式为为:2Cu2++4I-═2CuI↓+I2,
故答案为:2Cu2++4I-═2CuI↓+I2;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-═2CuI↓+I2;
得到 2Na2S2O3 ~2Cu2+
2 2
0.1000mol/L×0.0200L 0.002mol
则CuCl2•2H2O的物质的量为:0.002mol,
试样中CuCl2•2H2O的质量百分数为 $\frac{0.002mol/L×171g/mol}{0.36g}$×100%=95%,
故答案为:95%.
点评 本题考查Ksp计算和物质制备,利用平衡移动原理、氧化还原滴定分析解答,明确滴定过程的反应原理和计算方法是解本题的关键,注意加热灼烧CuCl2溶液和CuSO4溶液得到固体的区别,为易错点,题目难度中等.


科目:高中化学 来源: 题型:解答题
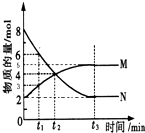 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Na2O2含有的阴、阳离子总数是0.3 NA | |
| B. | 1 mol•L-1的醋酸溶液中含醋酸分子数为NA | |
| C. | 常温常压下,2.24 L乙烯含有的碳碳双键数为0.1 NA | |
| D. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜属于重金属,但其盐有毒,所以铜质器皿不安全,应该禁用 | |
| B. | 燃煤中加入生石灰可以减少二氧化硫的排放 | |
| C. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| D. | 钠在空气和氯气中燃烧,火焰颜色和生成固体颜色都不 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,14g乙烯、丙烯、丁烯的混合气体,其原子数为3NA | |
| B. | 常温常压下,22.4L CO2含有CO2分子数为NA | |
| C. | 0.5mol•L-1 的CuCl2溶液中含Cl-数为 NA | |
| D. | 标准状况下,11.2L的CHCl3所含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积为44.8L | B. | 含有4mol氧原子 | ||
| C. | 分子数为6.02×1023 | D. | 摩尔质量为128g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com