
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
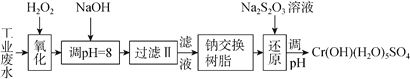
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是___(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子___(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)在还原过程中,每消耗172.8gCr2O72- 转移4.8mole-,则还原过程中该反应离子方程式为____。(已知在氧化过程中Cr3+转化为Cr2O72- )
(Ⅱ)酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理该废水,阳极反应是Fe-2e-![]() Fe2+,阴极反应式是2H++2e-
Fe2+,阴极反应式是2H++2e-![]() H2↑。
H2↑。
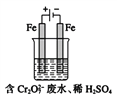
(1)电解时能否用Cu电极来代替Fe电极?______(填“能”或“不能”),理由是_____。
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为___________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因______________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化成沉淀的质量是_______g。
【答案】 A AB CD 3 S2O32-+4 Cr2O72-+13H2O=6SO42-+8Cr(OH)3↓+2OH- 不能 阳极产生的Cu2+不能使Cr2O72-还原到低价态 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O![]() H++OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全 84.8
H++OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全 84.8
【解析】I. 某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72还原为Cr3+,再调节pH得到Cr(OH)(H2O)5SO4。
(1).加氧化剂的主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案选A;
(2).根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去,故选AB;通过钠离子交换树脂,除去Ca2+和Mg2+,故选CD,故答案为:AB;CD;
(3).每消耗172.8gCr2O72- 即0.8molCr2O72转移4.8mole,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32被氧化为SO42,则反应的离子方程式为:3S2O32-+4Cr2O72-+13H2O=6SO42-+8Cr(OH)3↓+2OH-,故答案为:3 S2O32-+4 Cr2O72-+13H2O=6SO42-+8Cr(OH)3↓+2OH-;
II.(1).若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根离子发生反应,故答案为:不能;阳极产生的Cu2+不能使Cr2O72-还原到低价态;
(2).Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为Cr3+,反应的实质是:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3).根据电解原理可知,水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O![]() H++OH-向右移动,阴极区OH-浓度增大,与金属阳离子在阴极区结合而沉淀完全,故答案为:水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O
H++OH-向右移动,阴极区OH-浓度增大,与金属阳离子在阴极区结合而沉淀完全,故答案为:水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O![]() H++OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全;
H++OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全;
(4).根据Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,Cr3++3OH═Cr(OH)3↓、Fe3++3OH═Fe(OH)3↓可知0.1molCr2O72-反应时,可生成0.2molCr(OH)3,0.6molFe(OH)3,沉淀的总质量为:0.2mol×103g/mol+0.6mol×107g/mol=84.8g,故答案为:84.8。


科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O.正极电极反应式为 .
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2 , 若将此反应设计成原电池,则负极所用电极材料为 , 当线路中转移0.4mol电子时,则被腐蚀铜的质量为g.
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 .
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
(4)如图是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,A极为电源(填“正”或“负”)极,写出A极的电极反应式: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称为;
(2)A,B形成的化合物的电子式为 .
(3)C的元素符号为 , C的最高价氧化物的化学式为 .
(4)D的最高价氧化物对应的水化物的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NO2与水的反应:3NO2+H2O═2NO3﹣+NO+2H+
B.氯气通入水中:Cl2+H2O═2H++Cl﹣+ClO﹣
C.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
D.向硅酸钠溶液中通入SO2:SiO32﹣+2H+═H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2-硝基-1,3-苯二酚是橘黄色固体,易溶于水、溶液呈酸性,沸点为88℃,是重要的医药中间体。实验室常以间苯二酚为原料分以下三步合成:

具体实验步骤如下:
①磺化:称取5.5g碾成粉状的间苯二酚放入烧杯中,慢慢加入浓硫酸并不断搅拌,控制温度为60~65℃约15min。
②硝化:将烧杯置于冷水中冷却后加入混酸,控制温度(25±5) ℃左右继续搅拌15min。
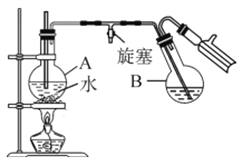
③蒸馏:将反应混合物移入圆底烧瓶B中,小心加入适量的水稀释,再加入约0.1g尿素,然后用下图所示装置进行水蒸气蒸馏;将馏出液冷却后再加入乙醇-水混合剂重结晶。
回答下列问题:
(1)实验中设计Ⅰ、Ⅲ两步的目的是__________。
(2)烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能_______
(3)步骤②的温度应严格控制不超过30℃,原因是_____________。
(4)步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇-水混合剂洗涤。请设计简单的实验证明2-硝基-1,3-苯二酚已经洗涤干净:______________。
(5)本实验最终获得1.0g橘黄色固体,则2-硝基-1,3-苯二酚的产率约为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀盐酸共热
B、1molCu与含2molH2SO4的浓硫酸共热
C、1molCu与含4molHNO3的浓硝酸
D、1molMnO2与含4molHCl的浓盐酸共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 合金一定是金属熔合而成的物质
B. 利用丁达尔效应可以鉴别Fe(OH)3胶体和FeCl3溶液
C. 当大量氯气泄漏时,用NaOH溶液浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D. 实验室常将氢氟酸保存在细口玻璃瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com