
分析 (1)B元素原子L层电子数是K层电子数的3倍,K层电子数是2,则L层电子数为6,故B为氧元素;
(2)根据“1.55gAx和0.80gBy的原子数相等”确定A的相对原子质量,根据A原子中的中子数比质子数多1,确定A的核内质子数.
解答 解:(1)由于“B原子的L层电子数是K层的3倍”,B为氧元素(O),
故答案为:O;
(2)已知1.55gAx和0.80gBy的原子数相等,则$\frac{1.55g}{M(A)}=\frac{0.8g}{M(B)}$,B为氧元素(O),则M(B)=16,所以M(A)=31,由于“A原子中的中子数比质子数多1”,假设质子数为Z,则Z+(Z+1)=31,Z=15,A为磷元素(P),
故答案为:15.
点评 本题考查元素的推断,B原子的L层电子数是K层的3倍B为氧元素,既是高频考点又是解题关键,侧重对基础知识的巩固,比较基础,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 | |
| D. | 元素原子的核外电子排布、原子半径及元素主要化合价的都发生周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
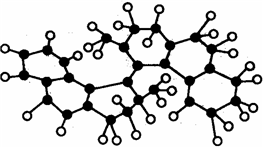 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )| A. | 溶于水 | B. | 可以燃烧 | ||
| C. | 能和溴水发生取代反应 | D. | 能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| B. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均可发生水解反应,且产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | △H1>△H2 | C. | Q1=Q2 | D. | △H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
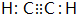 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

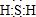 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.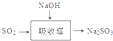 .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,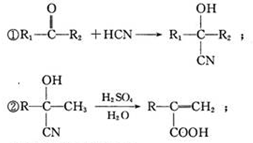
 .
. )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的异构体共有8种(不考虑立体异构),其中核磁共振氢谱有8组峰的是
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的异构体共有8种(不考虑立体异构),其中核磁共振氢谱有8组峰的是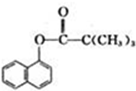 (写出其中一种的结构简式).
(写出其中一种的结构简式).
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com