

·ÖĪö ½šŹōAĪŖŹ³ŃĪÖŠµÄŌŖĖŲ£¬Ó¦ĪŖNa£¬ÓėŃõĘų·“Ӧɜ³ÉµÄGĪŖNa2O2£¬ÓÉ×Ŗ»Æ¹ŲĻµæÉÖŖ¼×ĪŖH2£¬»ĘĀĢÉ«ĘųĢåŅŅĪŖCl2£¬±ūĪŖHCl£¬CĪŖŃĪĖį£¬BĪŖNaOH£¬Éś³ÉDŗ¬ÓŠNaCl”¢NaClO£¬FĪŖĘÆ°×·ŪµÄÓŠŠ§³É·Ö£¬ŌņÓ¦ĪŖCa£ØClO£©2£¬EĪŖCaCl2£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗ£Ø1£©ÓÉŅŌÉĻ·ÖĪöæÉÖŖ±ūĪŖĀČ»ÆĒā£¬Dŗ¬ÓŠNaCl”¢NaClO£¬ĪŖĘÆ°×Ņŗ£¬FĪŖCa£ØClO£©2£¬GĪŖNa2O2£¬¹Ź“š°øĪŖ£ŗĀČ»ÆĒā£»ĘÆ°×Ņŗ£»Ca£ØClO£©2£»Na2O2£»
£Ø2£©ÄĘŗĶĖ®·“Ӧɜ³ÉĒāŃõ»ÆÄĘŗĶĒāĘų£¬·½³ĢŹ½ĪŖ2Na+2H2O=2NaOH+H2”ü£¬
ĒāŃõ»ÆÄĘŗĶĀČĘų·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘŗĶĖ®£¬·½³ĢŹ½ĪŖ2NaOH+Cl2=NaCl+NaCl+H2O£¬
ĒāŃõ»ÆøĘŗĶĀČĘų·“Ó¦µÄ·½³ĢŹ½ĪŖ2Ca£ØOH£©2+2Cl2=Ca£ØClO£©2+CaCl2+2H2O£¬
ÅØŃĪĖįŗĶ¶žŃõ»ÆĆĢŌŚ¼ÓČČĢõ¼žĻĀÉś³ÉĀČĘų£¬·½³ĢŹ½ĪŖ4HCl£ØÅØ£©+MnO2$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+2H2O+Cl2”ü£¬
¹żŃõ»ÆÄĘŗĶ¶žŃõ»ÆĢ¼·“Ӧɜ³ÉĢ¼ĖįÄĘŗĶŃõĘų£¬·½³ĢŹ½ĪŖ2Na2O2+2CO2=2Na2CO3+O2”ü£¬
¹Ź“š°øĪŖ£ŗ2Na+2H2O=2NaOH+H2”ü£»2NaOH+Cl2=NaCl+NaCl+H2O£»2Ca£ØOH£©2+2Cl2=Ca£ØClO£©2+CaCl2+2H2O£»4HCl£ØÅØ£©+MnO2$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+2H2O+Cl2”ü£»2Na2O2+2CO2=2Na2CO3+O2”ü£»
£Ø3£©ĘÆ°×·ŪµÄÖ÷ŅŖ³É·ÖĪŖCaCl2”¢Ca£ØClO£©2£¬³¤ĘŚĀ¶ÖĆæÕĘųÖŠŹ±“ĪĀČĖįøĘÓėĖ®”¢¶žŃõ»ÆĢ¼·“Ӧɜ³ÉĢ¼ĖįøĘŗĶHClO£¬HClOŅ×·Ö½ā£¬“Ó¶ų±äÖŹ£¬·¢Éś±äÖŹŹ±·¢ÉśµÄ·“Ó¦ĪŖCa£ØClO£©2+H2O+CO2=CaCO3+2HClO”¢2HClO$\frac{\underline{\;¹āÕÕ\;}}{\;}$2HCl+O2”ü£¬
¹Ź“š°øĪŖ£ŗCa£ØClO£©2+H2O+CO2=CaCO3+2HClO”¢2HClO$\frac{\underline{\;¹āÕÕ\;}}{\;}$2HCl+O2”ü£®
µćĘĄ ±¾ĢāŅŌĪŽ»śæņĶ¼ĢāµÄŠĪŹ½æ¼²éNa”¢ClµČŌŖĖŲµ„ÖŹ¼°Ęä»ÆŗĻĪļÖ®¼äµÄĻą»„×Ŗ»Æ¹ŲĻµ£¬ĪŖøßæ¼³£¼ūĢāŠĶ£¬²ąÖŲæ¼²éѧɜµÄ·ÖĪöÄÜĮ¦£¬×¢Ņā°ŃĪÕ»ÆѧŹ½µÄŹéŠ“”¢Ąė×Ó·½³ĢŹ½µČ£¬ÄѶČÖŠµČ£¬×¢Ņā»ł“”ÖŖŹ¶µÄÕĘĪÕ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0-2minµÄĘ½¾łĖŁĀŹv£ØX£©=0.01mol/£ØL•min£© | |
| B£® | Ę½ŗāŹ±YµÄ×Ŗ»ÆĀŹĪŖ0.5 | |
| C£® | ĘäĖüĢõ¼ž²»±ä£¬ÉżĪĀ£¬Ę½ŗāÄęĻņŅĘ¶Æ | |
| D£® | ĘäĖüĢõ¼ž²»±ä£¬Ōö¼ÓXµÄÅØ¶Č£¬vÕżŌö“ó£¬vÄę¼õÉŁ£¬Ę½ŗāÕżĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | Na2SO3 | B£® | Na2O | C£® | NaOH | D£® | ĀČĖ® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
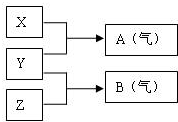 X”¢Y”¢ZĪŖČżÖÖ²»Ķ¬¶ĢÖÜĘŚ·Ē½šŹōŌŖĖŲµÄµ„ÖŹ£®ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗĒėÕė¶ŌŅŌĻĀĮ½ÖÖ²»Ķ¬µÄĒéæö»Ų“š£ŗ
X”¢Y”¢ZĪŖČżÖÖ²»Ķ¬¶ĢÖÜĘŚ·Ē½šŹōŌŖĖŲµÄµ„ÖŹ£®ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗĒėÕė¶ŌŅŌĻĀĮ½ÖÖ²»Ķ¬µÄĒéæö»Ų“š£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
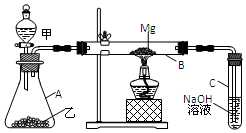 ŅŃÖŖSiO2”¢SO2ŗĶCO2¶¼ŹĒĖįŠŌŃõ»ÆĪļ£¬»ÆѧŠŌÖŹ¾ßÓŠŅ»¶ØµÄĻąĖĘŠŌ£»MgŗĶNaµÄ»ÆѧŠŌÖŹŅ²¾ßÓŠŅ»¶ØµÄĻąĖĘŠŌ£®ÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠMgŗĶSO2·“Ó¦µÄŹµŃ飮
ŅŃÖŖSiO2”¢SO2ŗĶCO2¶¼ŹĒĖįŠŌŃõ»ÆĪļ£¬»ÆѧŠŌÖŹ¾ßÓŠŅ»¶ØµÄĻąĖĘŠŌ£»MgŗĶNaµÄ»ÆѧŠŌÖŹŅ²¾ßÓŠŅ»¶ØµÄĻąĖĘŠŌ£®ÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠMgŗĶSO2·“Ó¦µÄŹµŃ飮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| t”ę | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ńõ»Æ»¹Ō·“Ó¦ÖŠŅ»¶ØÓŠŌŖĖŲ»ÆŗĻ¼ŪµÄÉż½µ | |
| B£® | Ąė×Ó»ÆŗĻĪļÕāŅ»¶Øŗ¬ÓŠ½šŹōŌŖĖŲ | |
| C£® | ÖĆ»»·“Ó¦Ņ»¶ØŹĒ½šŹōµ„ÖŹÓėŃĪĖįĄąÖ®¼äµÄ·“Ó¦ | |
| D£® | ŌŚ³£ĪĀŗĶ101kPa£¬1molČĪŗĪĘųĢåµÄĢå»żŌ¼ĪŖ22.4L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | Ąė×Ó·½³ĢŹ½ | ĘĄ¼Ū |
| A | ½«2molCl2ĶØČėµ½ŗ¬lmolFeI2µÄČÜŅŗÖŠ£ŗ2Fe2++2I-+2Cl2ØT2Fe3++I2+4Cl- | ÕżČ·£ŗCl2¹żĮ棬æɽ«Fe2+”¢I-¾łŃõ»Æ |
| B | Ļ”ĻõĖįÖŠ¼Ó¹żĮæĢś·Ū£ŗ3Fe+8H++2NO3-ØT3Fe2++2NO”ü+4H2O | ÕżČ·£ŗ¹żĮæµÄFe»¹ŌĮĖFe3+ |
| C | ¹żĮæSO2ĶØČėµ½NaClO ČÜŅŗÖŠ£ŗClO-+SO2+H2OØTHSO3-+HClO | ÕżČ·£ŗĖµĆ÷ĖįŠŌ£ŗH2SO3ĒæÓŚHClO |
| D | Mg£ØHCO3£©2ČÜŅŗÓė×ćĮæµÄNaOH ČÜŅŗ·“Ó¦£ŗMg2++HCO3-+OH-ØTMgCO3”ż+H2O+CO32- | ÕżČ·£ŗĖįŹ½ŃĪÓė¼ī·“Ӧɜ³ÉÕżŃĪŗĶĖ® |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com