考点:离子浓度大小的比较,盐类水解的应用,钠的重要化合物,铁的氧化物和氢氧化物
专题:基本概念与基本理论,元素及其化合物
分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.水解程度越大,水的电离程度越大;
C.n(Na
2O
2)=
=0.5mol,2Na
2O
2+2H
2O=4NaOH+O
2↑,根据过氧化钠和转移电子之间的关系式计算;
D.n( Fe
3O
4)=
=0.03mol,根据3Fe
3O
4+28HNO
3=9Fe(NO
3)
3+NO↑+14H
2O计算参加反应的硝酸的物质的量.
解答:
解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na
+)+c(H
+)=c(HRO
3-)+2c(RO
32-)+c(OH
-),故A错误;
B.水解程度越大,水的电离程度越大,铵根离子和碳酸根离子相互促进水解、亚铁离子抑制水解,所以三种溶液中水的电离程度:①>②>③,故B错误;
C.n(Na
2O
2)=
=0.5mol,2Na
2O
2+2H
2O=4NaOH+O
2↑,根据过氧化钠和转移电子之间的关系式得转移电子数=
×2×N
A/mol=0.5N
A,故C错误;
D.n( Fe
3O
4)=
=0.03mol,根据3Fe
3O
4+28HNO
3=9Fe(NO
3)
3+NO↑+14H
2O得参加反应的硝酸的物质的量=
×28=0.28mol,故D正确;
故选D.
点评:本题考查了盐类水解、氧化还原反应等知识点,根据盐的性质结合守恒思想分析AB,根据氧化还原反应中各个物理量之间的关系式进行计算CD,注意D中四氧化三铁中铁元素化合价、方程式的书写,为易错点.



 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案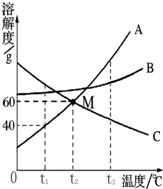 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答:

 可写成
可写成