
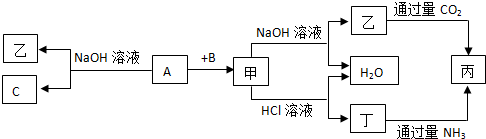
分析 由短周期元素组成的三种单质A、B、C和甲、乙、丙、丁四种化合物,甲是典型的两性氧化物,甲既能与酸反应又能与碱反应,则甲为Al2O3,甲也是工业上制取A的主要原料,而A能与与NaOH反应,则A为Al,故C为H2,乙为NaAlO2,B为O2,丁为AlCl3,丙为Al(OH)3,NaAlO2与二氧化碳反应生成Al(OH)3,AlCl3与氨水反应生成Al(OH)3,据此解答.
解答 解:甲是典型的两性氧化物,甲既能与酸反应又能与碱反应,则甲为Al2O3,甲也是工业上制取A的主要原料,而A能与与NaOH反应,则A为Al,故C为H2,乙为NaAlO2,B为O2,丁为AlCl3,丙为Al(OH)3,
(1)由上述分析可知,C为H2,乙为NaAlO2,
故答案为:H2;NaAlO2;
(2)A为Al,可用于制铝合金、导线等,故答案为:铝合金、导线等;
(3)A为Al,A与氧化铁发生铝热反应,反应的化学方程式为Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
点评 本题考查无机物推断,难度不大,需要学生熟练掌握元素化合物性质,比较基础.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大N2的浓度可使该反应的反应速率加快 | |
| B. | 升高温度,该反应的反应速率加快 | |
| C. | 将1 mol N2和3 mol H2混合进行反应,反应完成时得到2 mol NH3 | |
| D. | 单位时间内生成1 mol N2,同时消耗3 mol H2,说明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医学上,血液透析是利用了胶体的渗析原理 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
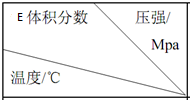 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 915℃,2.0 MPa 时 E 的转化率为 60% | |
| B. | K(810℃)>K(1000℃) | |
| C. | 该反应可在较低温度下自发进行 | |
| D. | e>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
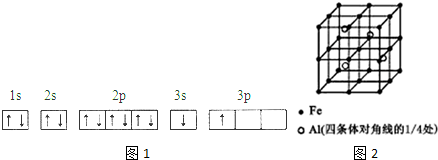
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
 、
、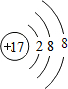 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
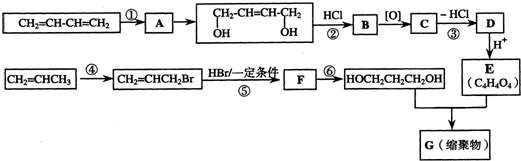
 .写出反应⑥的化学方程式:CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr.
.写出反应⑥的化学方程式:CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr.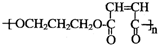 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com