
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
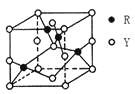
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
【答案】1s22s2sp6 sp3 Al2O3>CuO>CO2 CuO Na2CO3 SO32-+2Cu2++2Cl-+H2O=2CuCl↓+SO42-+2H+
【解析】
X、Y、Z、R为前四周期元素,原子序数依次增大,X、Y同周期,X基态原子的最外层电子数是次外层的2倍,其次外层电子数是2,则X是C元素,Y基态原子的s能级和p能级上电子数相等,则Y是O元素;Z是地壳中含量最高的金属元素,为Al元素;R+离子的3d轨道全充满,则R是Cu元素,据此解答。
(1)Z是Al元素,Al失去3个电子生成铝离子,根据构造原理书写铝离子核外电子排布式为1s22s2sp6;
(2)该二氧化碳为原子晶体,每个C原子和4个Si原子形成4个共价键,为sp3杂化;X、Z、R的单质分别与足量Y2充分反应所得产物分别是二氧化碳、氧化铝和CuO,氧化铝是原子晶体、CuO是离子晶体、二氧化碳是分子晶体,熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,所以晶体熔沸点高低顺序是Al2O3>CuO>CO2;
(3)该晶胞中Cu离子个数=4,氧离子个数=8×1/8+6×1/2=4,铜离子和氧离子个数之比=4:4=1:1,其化学式为CuO;
(4)常温下,pH相同的NaAlO2与Na2CO3两种溶液,偏铝酸根离子水解程度大于碳酸根离子,所以pH相同时碳酸钠浓度较大;
(5)盐酸、亚硫酸根离子和铜离子发生氧化还原反应生成CuCl白色沉淀、硫酸根离子,离子方程式为SO32-+2Cu2++2Cl-+H2O=2CuCl↓+SO42-+2H+。


科目:高中化学 来源: 题型:
【题目】碳、氧、氯、镁、镍、铜是几种重要的元素,请回答下列问题:
(1)镍元素的核电荷数为28,则基态原子的电子排布式为____________________,结构中有__________种不同形状的电子云。
(2)MgO的熔点高于CuO的理由是________________________________________。
(3)镁原子第一电离能反常地高于铝的原因是_____________________________。
(4)Ni与CO能形成配合物![]() ,该分子中
,该分子中![]() 键与
键与![]() 键个数比为__________。
键个数比为__________。
(5) ![]() 分子中的中心原子杂化轨道类型是__________,该分子的空间构型为__________。
分子中的中心原子杂化轨道类型是__________,该分子的空间构型为__________。
(6)铜与氧可形成如图所示的晶胞结构,其中铜原子均匀地分散在晶胞内部,a、b原子的坐标参数依次为(0,0,0)、![]() ,则d原子的坐标参数为____________________,已知:该晶体的密度为
,则d原子的坐标参数为____________________,已知:该晶体的密度为![]() ,
, ![]() 是阿伏加德罗常数的值,则晶胞参数为__________cm(列出计算式即可)。
是阿伏加德罗常数的值,则晶胞参数为__________cm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A有下列变化:
的有机物A有下列变化:

其中B、C的相对分子质量相等,下列有关说法错误的是( )
A.C和E互为同系物
B.符合题目条件的A共有4种
C.D既能发生氧化反应,又能发生还原反应
D.符合题目条件的B共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能达到实验目的的是
A. 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 在用稀硫酸和锌粒反应制取氢气时可以适当加热以加快化学反应速率
C. 向煮沸的l mol·L-1 NaOH溶液中滴加FeC13饱和溶液制备Fe(OH)3胶体
D. 称取19.0g SnCl2,用100 mL蒸馏水溶解,配制1.0 mol·L-1 SnC12溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的有
A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
B.电解饱和食盐水:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.氯气通入冷水中 Cl2 +H2O = Cl-+ClO-+2H+
D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸(![]() )常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
)常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
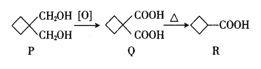
A.R与乙酸互为同系物
B.P、Q、R均能与金属钠反应
C.Q中所有碳原子不可能共平面
D.P的同分异构体中能与NaHCO3溶液反应的结构共有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)(NH4)2SO4中含有化学键的类型为_________________________。
(2)KNO3中NO3-的立体构型为____________________,其中N原子的杂化方式为________,写出与NO![]() 互为等电子体的另一种阴离子的化学式:_______________。
互为等电子体的另一种阴离子的化学式:_______________。
(3)已知配合物CrCl3·6H2O中心原子Cr3+的配位数为6,向含0.1 mol CrCl3·6H2O的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50 mL,则该配合物的化学式为________________,Cr在基态时,价电子排布式为_____________________。
(4)LiBH4由Li+和BH4-构成,BH4-的立体构型是____________,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为____________。
(5)丙酮(![]() )分子中C原子轨道杂化类型为_____________;含有的π键与σ键数目之比为___________。
)分子中C原子轨道杂化类型为_____________;含有的π键与σ键数目之比为___________。
(6)第一电离能I 1(Zn)______I 1(Cu)(填“大于”或“小于”),原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.0.5molAl与足量盐酸反应转移电子数为NA
C.46gNO2和N2O4的混合物含有的分子数为NA
D.同温同体积时,两种气体的压强比等于物质的量之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com