
工业上生产硫酸的流程图如下:

请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是________________________________________________________________________。
(2)在气体进入催化反应室前需净化的原因是_________________________ ________
________
_____________________ ___________________________________________________。
___________________________________________________。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以____________________________,从而提高生产效率。
(4)工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理:____________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是________。
A.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
B.海水提镁:海滩贝壳
 石灰水
石灰水

 MgO
MgO 镁
镁
C.工业制硝酸:空气 NO2
NO2 硝酸—→尾气处理
硝酸—→尾气处理
D.工业合成氨:天然气 氢气
氢气 NH3、H2、N2
NH3、H2、N2 氨
氨
科目:高中化学 来源: 题型:
下列有关化学用语以及化学基本概念的表述中正确的一组是( )
A. 过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同,两者互为同分异构体
B. 日本福岛核电站泄露的放射性核素Ⅰ和Cs,前者比后者少4个中子
C. 亚硫酸氢钠和碳酸氢钠的电离方程式都表示为NaHRO3⇋Na++HRO(R=C或S)
D. 次氯酸的结构式为HOCl,过氧化氢的电子式为H+[O O]2-H+
查看答案和解析>>
科目:高中化学 来源: 题型:
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
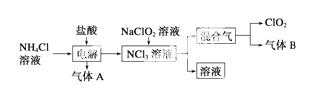
(1)ClO2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________。
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是________。
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为________________________________________________________________。
缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是________________________________________________________________________
________________________________________________________________________,
此法相比欧洲方法的优点是______________________________________________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_________________________________________________________
________________________________________________________________________。
此法提高了生产及储存、运输的安全性,原因是________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
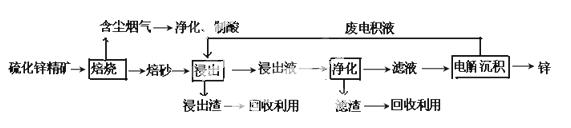
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤 炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即
炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即 倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉
倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉 甘石的主要成分为碳酸锌,倭铅是指金属锌)
甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)①普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。该电池中,负极材料主要是___ _________________,电解质的主要成分是__________,正极发生的主要反应是________________________________________________________。
_________________,电解质的主要成分是__________,正极发生的主要反应是________________________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
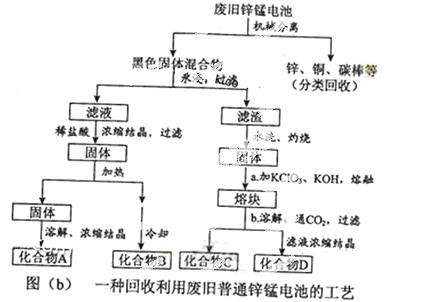
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知原子序数依次递增的5种非金属元素,A的原子半径在所有原子中最小,B元素组成的化合物种类最多,C的最外层电子数是内层电子数的3倍,且与B同周期,D与B同主族,E在C的下一周期,且是同周期元素中非金属性最强的元素。
回答下列问题:
(1)由A、B、C、E四种元素中的两种元素可形成多种分子,下列分子①BC2 ②BA4 ③A2C2 ④BE4,其中属于极性分子的是________(填序号)。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是_______________。
(3)B、C两元素都能和A元素组成两种常见的溶剂,其分子式为________、________。DE4在前者中的溶解性________(填“大于”或“小于”)在后者中的溶解性。
(4)BA4、BE4和DE4的沸点从高到低的顺序为_________________(填化学式)。
(5)A、C、E三种元素可形成多种含氧酸,如AEC、AEC2、AEC3、AEC4等,以上列举的四种酸其酸性由强到弱的顺序为______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯(如图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙).
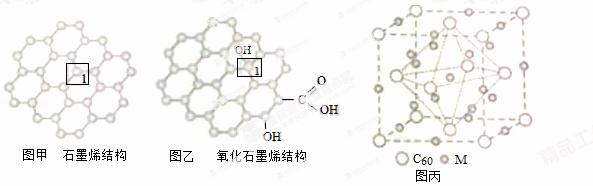
(1)图甲中,1号C与相邻C形成σ键的个数为 _________ .
(2)图乙中,1号C的杂化方式是 _________ ,该C与相邻C形成的键角 _________ (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角.
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有 _________ (填元素符号).
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为 _________ ,该材料的化学式为 _________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是_______ _(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
_(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关阿伏加德罗常数(NA)说法错误的是( )
A.32 g O2所含的原子数目为NA
B.0.5 mol H2O含有的原子数目为1.5NA
C.1 mol H2O含有的H2O分子数目为NA
D.0.5NA个氯气分子的物质的量是0.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com