
| A. | 将12.00g胆矾配成500mL溶液 | |
| B. | 称取7.68g硫酸铜,加入500mL水 | |
| C. | 将12.50g胆矾溶于少量水中,再用水稀释至500mL | |
| D. | 在80mL0.6mol/L CuSO4溶液中加入400mL水 |
分析 需要480mL溶液,应选择500ml容量瓶,只能配制500mL,根据n=c×V计算溶质的物质的量,配制硫酸铜溶液可以用硫酸铜,也可以用胆矾,根据m=n×M计算各自质量,配制溶液时注意水的体积不等于溶液的体积,据此解答.
解答 解:需要480mL溶液,应选择500ml容量瓶,只能配制500mL,配制500mL 0.100mol•L-1的CuSO4溶液,溶质的物质的量为:n=c×V=0.5L×0.100mol/L=0.0500mol,需要硫酸铜溶质的质量为:m(CuSO4)=0.05mol×160g/mol=8.0g,需要胆矾的质量为:m(CuSO4•H2O)=0.05mol×250g/mol=12.5g,
A.配制500mL 0.100mol•L-1的CuSO4溶液,需要胆矾的质量12.5g,故A错误;
B.配制500mL 0.100mol•L-1的CuSO4溶液,需要硫酸铜8.0g,故B错误;
C.12.50g胆矾物质的量为0.05mol,再用水稀释至500mL,得到硫酸铜溶液浓度为0.10mol/L,故C正确;
D.在80mL0.6mol/L CuSO4溶液中加入400mL水,溶质的物质的量为0.48mol,溶液的体积不等于480ml,所以溶液的物质的量浓度不等于0.1mol/L,故D错误;
故选C.
点评 本题考查了配制一定物质的量浓度溶液,熟悉配制原理,明确溶质的质量的计算方法是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | X分别和其它四种元素均可形成至少2种化合物 | |
| B. | M分别和w、X、Y、Z形成化合物,均显相同化合价 | |
| C. | M、X、Z三种元素组成的化合物含有离子键 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.1% | B. | 72.6% | C. | 84.7% | D. | 6.05% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
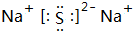 ,D原子的质子数和中子数相等,D的原子组成符号为1632 S.
,D原子的质子数和中子数相等,D的原子组成符号为1632 S.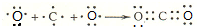 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Ba2+、Cl-、NO3- | B. | K+、OH-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
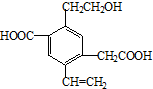
| A. | 该物质在Cu或Ag催化作用下加热,能够被氧化为相应的醛 | |
| B. | 可以用酸性高锰酸钾溶液检验,紫红色褪去,证明其含有碳碳双键 | |
| C. | 1mol该有机物,一定条件下最多可以和4molH2加成 | |
| D. | 该物质消耗Na、NaHCO3、Cu(OH)2的物质的量之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1 的 NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与 0.1 mol•L-1NaOH 溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | CH3COONa 和 CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 含等物质的量的 NaHC2O4和 Na2C2O4的溶液:2 c(Na+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com