
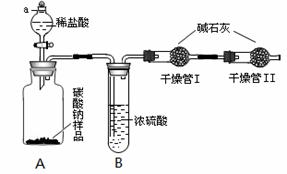
 某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下:
①按图将仪器组装好并检查气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的
质量(设为m1);③准确称量纯碱样
品的质量(设为n),放入广口瓶A
内;④打开分液漏斗a的旋塞,缓缓
滴入稀盐酸,至不再产生气泡为止;
⑤称量干燥管Ⅰ的质量(设为m2)。
(1)实验操作④要缓缓地进行,其理
由是________________。如果操作太快,会导致测定结果________(填偏大、偏小或不变)。(2)装置B的作用是_____________________;干燥管Ⅱ的作用是___________________。(3)根据甲同学的实验数据,写出计算纯碱样品纯度的公式_______________________
(4)方案评价:乙同学认为甲同学的方案有缺陷。乙同学认为稀盐酸要改为稀硫酸,否则
会导致测定结果偏大。你认为还有其它缺陷吗?如果有,提出你的改进意见或需要添加的实
验步骤,并指出甲同学缺少这一步骤会对结果产生什么影响(填偏大、偏小或不变),将答
案填入表中(不一定要填满)。
| 序号 | 改进意见 | 缺少时的影响 |
| ① | ||
| ② | ||
| ③ |
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
在含有FeCl3和BaCl2的强酸性溶液中通入足量的SO2有白色沉淀生成。由此得出的结论是( )
①白色沉淀是BaSO4 ②白色沉淀是BaSO3
③白色沉淀是BaSO3和BaSO4的混合物
④FeCl3被SO2还原为FeCl2
A.①③ B.②④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。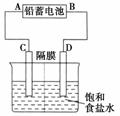 已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO
已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO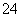 -2e-===PbSO4
-2e-===PbSO4
正极PbO2+4H++SO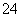 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式__ ▲ __ 。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为 ▲ __极。
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1. 15 g/cm3)时,
①若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为 ▲ __ L。
②若消耗硫酸amol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出) ▲ __ (用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列可用来鉴别SO2和CO2气体的试剂有
①澄清石灰水②氢硫酸③氯水④酸性高锰酸钾⑤硝酸钡溶液⑥紫色石蕊试液⑦品红溶液
A.②③④⑤⑦ B.①④⑤⑥⑦ C.①②③⑥⑦ D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取
Ti的反应为
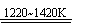
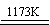 aTiO2 + bCl2+eC aTiCl4+eCO Ⅰ
aTiO2 + bCl2+eC aTiCl4+eCO Ⅰ
TiCl4+2Mg Ti+2MgCl2 Ⅱ
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;②C、Mg在两个反应中均被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=e =2 ⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在氧化还原反应中,下列叙述正确的是 ( )
A. 物质失电子的反应为氧化反应
B. 物质在变化中失去电子,此物质是氧化剂
C. 发生电子转移的反应即是氧化还原反应
D. 发生化合价升降的反应不一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2溶于水后,与水反应生成H2SO3,下列对于H2SO3的性质预测正确的是
A.有氧化性,无还原性,无酸性 B.有氧化性,有还原性,有酸性
C.有还原性,无氧化性,无酸性 D.有还原性,无氧化性,有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10﹣16 | 2.2×10﹣20 | 4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说
法错误的是
A. 向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B. 向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C. 该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D. 将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com