
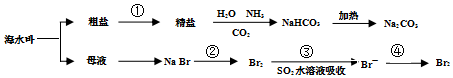
| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第②、④步骤中,溴元素均被氧化 | |
| D. | 制取NaHCO3的反应中,利用了其溶解度在相同条件下小于NaCl的性质 |
分析 海水分离得到粗盐和母液,粗盐通过精制得到精盐,得到氯化钠饱和溶液后依次通入氨气、二氧化碳反应生成碳酸氢钠晶体,加热分解得到碳酸钠;母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴,
A、工业上是电解熔融的氯化镁来制取金属镁;
B、碳酸钠和碳酸氢钠和氢氧化钙之间均能反应,都会出现白色沉淀;
C、化合价升高的元素在反应中做还原剂被氧化;
D、在混合溶液中,溶解度小的物质会先结晶析出.
解答 解:A、工业上是电解熔融的氯化镁来制取金属镁,故A正确;
B、碳酸钠、碳酸氢钠和氢氧化钙之间均能反应,且都会出现白色沉淀,所以用澄清的石灰水不可鉴别NaHCO3和Na2CO3,故B错误;
C、第②步中,溴元素化合价从-1升高到0价,被氧化,第④步中,溴元素化合价从-1升高到0价,被氧化,故C正确;
D、向饱和食盐水中通入氨气以及二氧化碳,溶解度较小的碳酸氢钠会先析出,制取NaHCO3的反应是利用其溶解度小于NaCl,故D正确;
故选B.
点评 本题是一道海水资源的综合利用方面的题目,属于综合知识的考查题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入FeCl3浓溶液或固体后,溶液颜色加深 | |
| B. | 加入少量KCl固体,增大了生成物浓度,平衡向逆反应方向移动,溶液颜色变浅 | |
| C. | 滴加几滴NaOH溶液,有红褐色沉淀生成,溶液颜色加深 | |
| D. | 加入几滴AgNO3溶液,有白色沉淀生成,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-是该反应的催化剂,它可增加该反应的活化分子百分数 | |
| B. | H2O2分解的反应快慢主要由反应①决定的 | |
| C. | 反应速率与I-的浓度有关 | |
| D. | 2v(H2O2)=2v(H2O)=v(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标态下 22.4 升氧气 | |
| B. | 常温常压下 66 克的 CO2 | |
| C. | 1.2mol 的硫酸 | |
| D. | 100ml,0.1mol•L-1 的氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化目的是为了提高轻质油产量和质量 | |
| B. | 淀粉、纤维素、油脂都是高分子化合物 | |
| C. | 可以通过分液的方法分离乙酸乙酯和水的混合物 | |
| D. | 紫外线、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | B | C | D |
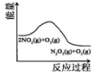 | 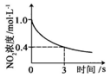 |  | 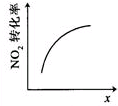 |
| 升高温度,平衡常数 减小 | 0~3s内,反应速率为v(NO2)=0.2mol•L-1•s-1 | t1时仅加入催化剂,平 衡向正方向移动 | 达平衡时,仅改变x, 则x为c(O2) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 gH218O含有的中子数为5NA | |
| B. | 标准状况下,2.24LCH2Cl2含有的分子数为0.l NA | |
| C. | 1 mol氯气参加反应时,电子转移数目一定为2NA | |
| D. | 常温下,pH=6的纯水中OH-的数目为10-8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
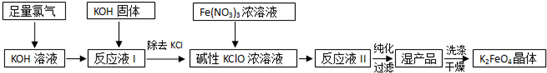
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com