
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在同一条件下,不同物质有不同的焓值,其体系的混乱程度越大,焓值越大 | |
| D. | AgCl在浓度相同的MgCl2溶液和KCl溶液中的溶解度相同 |
分析 A、化学反应速率与反应放热还是吸热无关;
B、据盖斯定律解答;
C、熵值与物质的混乱度有关,体系的混乱程度越大,熵值越大;
D、根据影响沉淀溶解平衡的因素分析.
解答 解:A、反应速率与反应是吸热还是放热无关,反应速率与反应物本身的性质及外界条件有关,故A错误;
B、焓变等于生成物能量和与反应物能量和的差,对于同一个反应,不论几步完成,反应物和生成物不变,所以焓变不变,故B正确;
C、熵值与物质的混乱度有关,体系的混乱程度越大,熵值越大,焓值与物质的能量有关,故C错误;
D、由于物质的量浓度相同的BaCl2和KCl溶液中氯离子浓度不同,所以氯化银的溶解度不同,故D错误;
故选B.
点评 本题考查影响化学反应速率的因素、熵变与焓变的区别、盖斯定律、沉淀的溶解平衡等,比较基础,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H=-283.0kJ/mol | |
| B. | 稀盐酸和稀氢氧化钠溶液反应的中和热为57.3kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为$\frac{1}{2}$H2SO4(l)+KOH(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l);△H=-57.3kJ/mol | |
| C. | 铝热反应是放热反应,但需要足够的热量才能使反应发生 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4克 | B. | 3.3克 | C. | 2.2克 | D. | 1.1克 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$ O2(g)=CO(g)△H=-110.5 kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$ O22(g)=CO2(g)△H=-283.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONH4?$C{H}_{3}CO{O}^{-}$+$N{H}_{4}^{+}$ | B. | CH3COOH=H++$C{H}_{3}CO{O}^{-}$ | ||
| C. | KHCO3?K++H++$C{O}_{3}^{2-}$ | D. | KHSO4=K++H++$S{O}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象或反应 | 原理解释 | |
| A | 锌与盐酸反应时,加入几滴氯化铜溶液可加快反应速率 | 氯化铜作反应的催化剂 |
| B | 将一小块金属钠投入水中,金属钠熔成小球 | 该反应△H>0 |
| C | 镀层破损后,镀锡铁比镀锌铁易腐蚀 | 锡比锌活泼 |
| D | 把铜片插入三氯化铁溶液中,在铜片表面不能出现一层铁 | Cu+2Fe3+=Cu2++2Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图装置可以用来制取某些气体.
如图装置可以用来制取某些气体.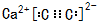 (填电子式)分液漏斗中盛放的是饱和食盐水,目的是使反应产生乙炔的速率平缓.
(填电子式)分液漏斗中盛放的是饱和食盐水,目的是使反应产生乙炔的速率平缓.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B、C、D形成的简单离子,半径最小的是B | |
| B. | E形成最简单氢化物稳定性比B强 | |
| C. | A、C、D形成的最高价氧化物的水化物两两间可相互反应 | |
| D. | A、B形成的化合物与B、E形成的化合物化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com