
分析 (1)二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子;
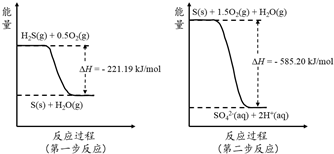
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJ•mol-1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJ•mol-1;
依据盖斯定律计算反应热;
(3)①原电池中阳离子移向正极,依据二氧化硫、氧气发生反应判断电极,判断质子移动方向;
②二氧化硫在负极失去电子发生氧化反应;
(4)①碳酸钠溶液中通入过量的二氧化硫反应生成亚硫酸氢钠和二氧化碳;
②二氧化硫为酸性氧化物,能够与氢氧化钙溶液反应,可以用氢氧化钙吸收二氧化硫.
解答 解:(1)二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子,离子方程式:SO2+H2O?H2SO3;H2SO3?H++HSO3-;
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJ•mol-1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJ•mol-1;
依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJ•mol-1;
故答案为:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJ•mol-1
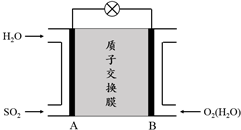
(3)①二氧化硫发生氧化反应,氧气发生还原反应,所以二氧化硫所在电极为负极,氧气所在电极为正极,原电池中阳离子移向正极,所以质子移动方向为:从A到B;
故答案为:从A到B;
②二氧化硫在负极失去电子发生氧化反应,电极反应式为:SO2-2e-+2H2O═SO42-+4H+;
故答案为:SO2-2e-+2H2O═SO42-+4H+;
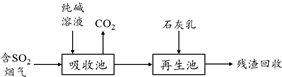
(4)①碳酸钠溶液中通入过量的二氧化硫反应生成亚硫酸氢钠和二氧化碳,离子方程式:H2O+2SO2+CO32-═2HSO3-+CO2;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2;
②二氧化硫为酸性氧化物,能够与氢氧化钙溶液反应,可以用氢氧化钙吸收二氧化硫;
故答案为:Ca(OH)2.
点评 本题为综合题,考查了离子方程式、热化学方程式的计算、盖斯定律计算反应热、电极反应式书写,明确二氧化硫的性质及离子方程式、热化学方程式书写方法、原电池工作原理是解题关键,题目难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液可能呈中性 | |
| B. | 反应停止后一定有固体剩余 | |
| C. | 反应过程中一定有氧化还原反应发生 | |
| D. | 若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Fe+2HCl═H2↑+FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
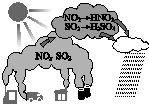
| A. | 汽车尾气是导致酸雨的原因之一 | B. | 酸雨会使土壤、湖泊酸化 | ||
| C. | 酸雨形成中不涉及氧化还原反应 | D. | 燃煤中加入石灰石可防治酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 编号 | 溶液X | 实验现象 |
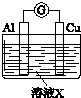 | 实验Ⅰ | 6mol•L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
| 实验Ⅱ | 15mol•L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
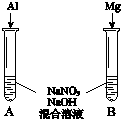 (3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.
(3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe+4H2O═Fe2O3+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | Ca(OH)2+SO2═CaSO3+H2O | D. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com