
【题目】碳酸钠的结晶水合物在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体( Na 2CO3·nH2O )。为测定其组成,某同学在不同温度下加热样品(温度逐渐升高),实验结果记录如 下:
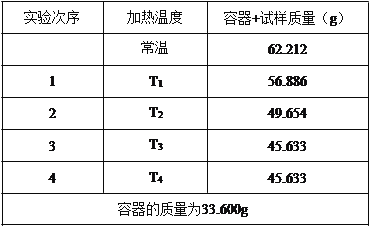
(1)该实验称量用的仪器是_____;实验记录中的容器是指_____(填仪器名字);冷却必须放在_____中进行(填仪器名称)。
(2)该学生停止实验的依据是_____。
(3)该样品中 n 的值为_____。(保留一位小数)
(4)若该实验过程中出现下列操作,其中可能会使实验结果 n的值偏大的是(______)
A.容器内壁原来附着有受热不分解的物质
B.碳酸钠晶体样品已有少量风化
C.加热后容器在空气中冷却
D.加热过程中有少量晶体溅出
(5)如果碳酸钠晶体样品不纯,测定结果(______)
A.没有偏差 B.一定偏小
C.一定偏大 D.无法确定
【答案】 电子天平 坩埚 干燥器 第 3、4 次称量质量相等 8.1 D D
【解析】(1)①实验室称量固体的质量数据最小量度单位为0.001g,则该实验称量用的仪器是电子天平而不是托盘天平;加热烘干固体的仪器是坩埚,坩埚应用坩埚钳取出后放在干燥器中冷却防止受潮;
(2)因为第3、4次实验称量时质量已恒重,说明样品已完全失去水至固体质量不变。
(3)m(H2O)=62.2g-45.633g=16.579g;m(Na2CO3)=45.633g-33.600=12.033g
Na2CO3·nH2O == Na2CO3 + nH2O
106 18n
12.033g 16.579g 解得n=8.1
(4)A.容器内壁原来附着有受热不分解的物质,无影响;B.碳酸钠晶体样品已有少量风化,晶体中水偏少,则求得水的质量偏小,所以求出的n偏小;C.加热后容器在空气中冷却,又吸收水分,则求得水的质量偏小,所以求出的n偏小;D.加热过程中有少量晶体溅出,则求得水的质量偏大,则求出的n偏大;故答案选D。
(5)(5)如果碳酸钠晶体样品不纯,若杂质易解解,则求得水的质量偏大,则求出的n偏大;若杂质受热不反应,则无影响;若杂质易与空气中物质反应,则求得水的质量偏小,所以求出的n偏小;故无法确定,选D。
点晴:称量选择什么仪器,需要根据实验要求而定,由数据精确值来选择仪器,如精确到0.1g,可选用托盘天平,精确到0.0001g时需要选择电光天平;误差分析要抓住计算公式,根据公式中物质的质量变化来确定对数年的影响。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】分子晶体具有某些特征的本质原因是( )
A. 组成晶体的基本粒子是分子 B. 熔融时不导电
C. 晶体内微粒间以分子间作用力相结合 D. 熔点一般比原子晶体低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取乙酸乙酯。
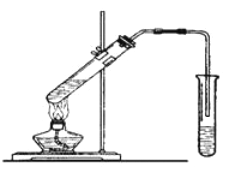
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,操作步骤如下: _________________________,然后轻振荡使其混合均匀。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是 _______________________________________________。
(3)浓硫酸的作用是:① _______________; ② ______________。
(4)图中右边试管中试剂是 _____________________________。
(5)分离得到乙酸乙酯的方法是________________,分离需要的玻璃仪器是___________。
(6)若加的是C2H518OH写出制乙酸乙酯的方程式______________________________________
(7)写出乙酸与碳酸氢钠反应方程式_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧热的热化学方程式为________(填选项字母)。
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9 kJ·mol-1
B.H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2O+O2=2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+![]() O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+________![]() ________+________
________+________
④2HgO![]() 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:_____________;请根据“绿色化学”的思想评估该方法制H2的主要缺点:___________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。

请写出化学方程式:
反应①__________________________。
反应②__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是

A. 图中甲池为原电池装置,Cu电极发生还原反应
B. 实验过程中,甲池左侧烧杯中![]() 的浓度不变
的浓度不变
C. 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
D. 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由 图分析不能得出的结论是( )

A. a是反应物
B. 正反应是一个体积扩大的反应
C. 若升高温度,a的转化率增大
D. 若增大压强,a的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积固定的密闭容器中发生可逆反应:A (g)+2B (g)![]() C (s)+D (g),能说明反应已达到平衡状态的事实是
C (s)+D (g),能说明反应已达到平衡状态的事实是
A. 容器内A、B、C、D四者共存 B. νA(正)=2νB(逆)
C. 容器内各种物质的浓度不再改变 D. νA(正)=νC(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙葵醛是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)X的名称是_______
(2)下列有关龙葵醛和C3H6(烯烃)的说法正确的是________(填序号)。
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(3)反应⑤的试剂和条件是________,反应③的反应类型是__________。
(4)有机物T所含官能团的名称是________,反应④的化学方程式为__________。
(5)在T的同分异构体中,遇氯化铁溶液发生显色反应的有_____种,其中,在核磁共振氢谱上有4 组峰且峰的面积之比为1:2 :3 :6 的结构简式为_________(写出其中的一种)。
(6) 参照上述流程图(如R![]() X……),以2-甲基-1,3-丁二烯为原料,经三步制备2-甲基-1,4-丁二醛,设计合成路线:________________。
X……),以2-甲基-1,3-丁二烯为原料,经三步制备2-甲基-1,4-丁二醛,设计合成路线:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com