
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 75pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有5种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质部分性质 | 密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-196.0℃不能导电 | 密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |

| 1 |
| 2 |
| 3 |
| 2 |
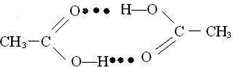 ,
,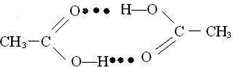 .
.


科目:高中化学 来源: 题型:
A、 和 和 |
B、 和H3C-CH2-NO2 和H3C-CH2-NO2 |
| C、H3C-CH2-CH2-COOH和H3C-CH2-CH2-CH2-COOH |
D、H3C-CH2-O-CH2-CH3和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有硫元素被氧化 |
| B、NO是还原产物 |
| C、还原剂与氧化剂的物质的量之比是3:16 |
| D、0.3mol Cu(NO3)2生成时转移电子0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
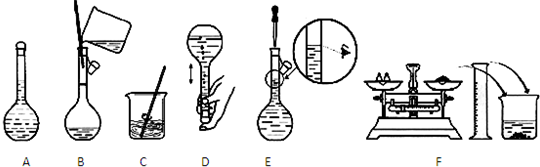
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,请完成下列问题:
,请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com