
阅读下列材料后,回答相应问题。
一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行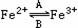 的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做 _剂,具有 性。
(3)向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体,则其离子方程式为: 。
(4)为了验证Fe3+的性质,某化学兴趣小组设计了如下图所示的一组实验,其中实验结果一定错误的是 。(填字母)
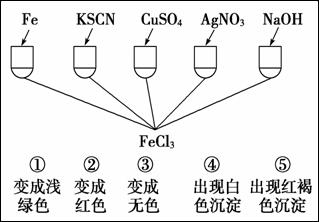
A.④和⑤ B.只有③ C.③和④ D.①②③
(5)已知:氧化性Cl2 > Br2 > Fe3+, 还原性Fe2+ >Br— >Cl—,则向0.2 mol·L—1 1L FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是 ,此反应的离子方程式: 。
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
下面对SO2和CO2的描述正确的是
A.都是直线形结构 B.中心原子都采取sp杂化
C.S原子和C原子上都没有孤电子对 D.SO2为V形结构,CO2为直线形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11 。则25 ℃条件下,下列说法正确的是
A.饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是( )
A. 1 mol·L—1 Na2CO3溶液中的CO32-数目为NA
B. 标准状况下,11.2L H2O中含有的电子数目为5NA
C. 1 mol Na与足量O2反应生成Na2O或Na2O2失去电子数目均为NA
D. 2.7g金属铝无论与强碱还是强酸作用时失去电子数目均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为( )
A.1.14g B.1.6g C.2.82g D.4.36g
查看答案和解析>>
科目:高中化学 来源: 题型:
据《自然》杂志报道,在300~400℃的高温下,将砂糖(主要成分为蔗糖)等碳水化合物用加热的方法使其形成焦糖与碳之间的“半成品碳”状态,再放进硫酸溶液中高温加热,生成了一种叫“焦糖烯”的物质,其分子式为C36H50O25。下列有关说法正确的是
A.“半成品碳”在硫酸溶液中加热可能发生的是消去反应
B.“半成品碳”是碳元素的一种新单质
C. 蔗糖溶液与新制的氢氧化铜悬浊液混合加热有砖红色沉淀生成
D. 焦糖烯是一种新型的烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生
产中保持恒温恒容条件):
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是
A.向装置中充入N2 B.向装置中充入过量的SO2
C.向装置中充入O2 D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及
固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一
反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g) 、3.5 mol O2
(g) 、1mol SO3 (g) ,下列说法正确的是
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
 D.第二次平衡时SO3的体积分数等于2/9
D.第二次平衡时SO3的体积分数等于2/9
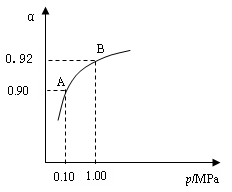
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是: ,并比较不同压强下的平衡常数:K(0.10 MPa)
K(1.0 MPa)(填 “<”或“>”或“=”)。
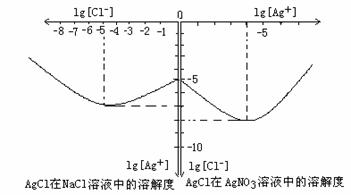 ⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- = [AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- = [AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为 。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是( )。
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-===Cu,
乙中负极为Mg-2e-=== Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是( )
A. 镭比钙的金属性更强 B. 在化合物中是+2价
C. 镭是一种放射性元素 D. 氢氧化镭呈两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com