
分析 (1)硫代硫酸钠与稀硫酸反应生成二氧化硫、硫、硫酸钠和水
(2)反应生成的二氧化硫具有漂白性,可以使品红溶液褪色检验二氧化硫的存在;
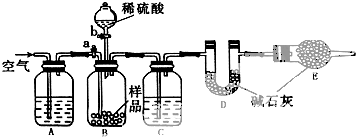
(3)①分析装置图是利用D吸收生成的二氧化硫计算,需要检查装置气密性;
②为了准确测定二氧化硫气体的质量,需要防止空气中的二氧化碳、水蒸气对测定结果的干扰,利用空气通入把生成的气体全部赶入装置D中吸收,需要先通过氢氧化钠溶液吸收空气中的二氧化碳,生成的气体中含有水蒸气需要通过装置C中的浓硫酸干燥;
③充分反应后,需关闭活塞b,打开活塞a,缓缓通入空气一段时间是为了把生成的气体全部赶入装置D中完全吸收;
④依据装置D吸收气体质量变化计算生成的二氧化硫质量,二氧化硫是亚硫酸钠和硫代硫酸钠于硫酸反应生成列式计算;
解答 解:(1)硫代硫酸钠在生产过程中常混入少量的亚硫酸钠(Na2SO3),Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,
故答案为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O;
(2)硫代硫酸钠在生产过程中常混入少量的亚硫酸钠(Na2SO3),Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,生成的二氧化硫具有漂白性,可以使品红溶液褪色,可以检验二氧化硫的存在,装置C中应盛有品红溶液;
故答案为:品红,品红溶液褪色;
(3)①分析装置图是利用D吸收生成的二氧化硫计算,需要检查装置气密性;
故答案为:检查装置气密性;
②为了准确测定二氧化硫气体的质量,需要防止空气中的二氧化碳、水蒸气对测定结果的干扰,利用空气通入把生成的气体全部赶入装置D中吸收,需要先通过氢氧化钠溶液吸收空气中的二氧化碳,生成的气体中含有水蒸气需要通过装置C中的浓硫酸干燥,装置A、C中应分别盛有;氢氧化钠溶液,浓硫酸溶液;
故答案为:氢氧化钠溶液,浓硫酸溶液;
③充分反应后,需关闭活塞b,打开活塞a,缓缓通入空气一段时间是为了把生成的气体全部赶入装置D中完全吸收,减少测定误差;
故答案为:将装置中的二氧化硫排除以被D完全吸收;
④依据装置D吸收气体质量变化计算生成的二氧化硫质量,二氧化硫是亚硫酸钠和硫代硫酸钠于硫酸反应生成列式计算,装置D的质量分别为m4 g、m5 g,吸收的二氧化硫质量为m5 g、m54g,;样品中Na2SO3的质量分数为a,则硫代硫酸钠的质量=m1(1-a)g,亚硫酸钠的质量为m1ag,依据硫元素守恒计算生成的二氧化硫物质的量:$\frac{{m}_{5}-{m}_{4}}{64}$=$\frac{{m}_{1}(1-a)}{158}$+$\frac{{m}_{1}a}{126}$,
故答案为:$\frac{{m}_{5}-{m}_{4}}{64}$=$\frac{{m}_{1}(1-a)}{158}$+$\frac{{m}_{1}a}{126}$;
点评 本题考查了物质组成的含量实验测定方法和过程分析,实验注意问题和减少误差的操作,元素守恒的计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和SO2 | B. | 甲醛和苯等有机物 | ||
| C. | SO2和NO2 | D. | O3和Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3固体加入新制氯水,有无色气泡生成(H+) | |
| B. | 使红色布条褪色(HClO) | |
| C. | 向NaBr溶液中滴加氯水,再滴加CCl4,发现下层为橙红色(HCl) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| B. | 滴加石蕊试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com