
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为过氧化钠,A与CO2反应的化学方程式为___,A与水反应的离子方程式为___。
(2)①向饱和C溶液中通CO2,化学方程式为:___。
②1mol/L的B溶液逐滴加入1L1mol/L的AlCl3溶液中,产生白色沉淀39g,则所加入的B溶液的体积可能为___L。
(3)下列图象中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图象的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是___;
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是___;
Ⅲ.表示向NaAlO2溶液中通入CO2的是___;
Ⅳ.③图___(填“能”或“不能”)代表向含NaOH的澄清石灰水中通入CO2。
【答案】2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4Na++4OH-+O2↑ Na2CO3+CO2+H2O=2NaHCO3↓ 1.5 3.5 ① ⑤ ⑥ 不能
【解析】
(1)含钠元素的物质在常温下能和水反应的有Na、Na2O2、Na2O,其中Na和Na2O2和水生成NaOH和气体,符合题目要求。所以B为NaOH,C为Na2CO3,D为NaHCO3。
(2)向AlCl3溶液中加入NaOH溶液,若NaOH少量,产生Al(OH)3沉淀,当AlCl3耗尽时,再加NaOH溶液,Al(OH)3会溶解。
(3)根据发生反应的离子方程式判断相应的图像。
(1)若A为过氧化钠,则过氧化钠与CO2反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2,过氧化钠与水反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑。
(2)①C为Na2CO3,向饱和C溶液中通CO2,由于生成的NaHCO3溶解度小,会成为晶体析出,化学方程式为:Na2CO3+CO2+H2O=2NaHCO3↓。
②B为NaOH,1mol/L的B溶液逐滴加入1L1mol/L的AlCl3溶液中,产生白色沉淀39g。n(AlCl3)=1mol,n[Al(OH)3]=![]() =0.5mol。存在两种可能:NaOH少量和NaOH过量。若NaOH少量,产生沉淀的物质的量由NaOH决定,Al3++3OH-=Al(OH)3↓,此时加入的n(NaOH)=3n[Al(OH)3]=1.5mol,NaOH溶液的体积为1.5L。若NaOH过量,则加入的NaOH先把AlCl3全部沉淀为Al(OH)3:Al3++3OH-=Al(OH)3↓,此时消耗n(NaOH)=3n(AlCl3)=3mol,生成Al(OH)31mol,然后继续加入NaOH溶液,溶解部分Al(OH)3,使剩余的Al(OH)3为0.5mol,所以需要溶解Al(OH)3的物质的量为1-0.5=0.5mol,发生反应:Al(OH)3+OH-=AlO2-+2H2O,溶解Al(OH)3需要的NaOH的物质的量为0.5mol,这种情况下共消耗NaOH:3+0.5=3.5mol,则加入的NaOH溶液的体积为3.5L。故答案为1.5,3.5。
=0.5mol。存在两种可能:NaOH少量和NaOH过量。若NaOH少量,产生沉淀的物质的量由NaOH决定,Al3++3OH-=Al(OH)3↓,此时加入的n(NaOH)=3n[Al(OH)3]=1.5mol,NaOH溶液的体积为1.5L。若NaOH过量,则加入的NaOH先把AlCl3全部沉淀为Al(OH)3:Al3++3OH-=Al(OH)3↓,此时消耗n(NaOH)=3n(AlCl3)=3mol,生成Al(OH)31mol,然后继续加入NaOH溶液,溶解部分Al(OH)3,使剩余的Al(OH)3为0.5mol,所以需要溶解Al(OH)3的物质的量为1-0.5=0.5mol,发生反应:Al(OH)3+OH-=AlO2-+2H2O,溶解Al(OH)3需要的NaOH的物质的量为0.5mol,这种情况下共消耗NaOH:3+0.5=3.5mol,则加入的NaOH溶液的体积为3.5L。故答案为1.5,3.5。
(3)Ⅰ.向AlCl3溶液中逐渐滴加NaOH溶液,先发生反应:Al3++3OH-=Al(OH)3↓,然后发生反应:Al(OH)3+OH-=AlO2-+2H2O,生成沉淀消耗的NaOH的物质的量和沉淀溶解消耗的NaOH的物质的量之比为3:1,故选①;
Ⅱ.向NaAlO2溶液中逐渐滴加稀盐酸,先发生反应:AlO2-+H++H2O=Al(OH)3↓,然后发生反应:Al(OH)3+3H+=Al3++3H2O,生成沉淀消耗的HCl的物质的量和沉淀溶解消耗的HCl的物质的量之比为1:3,故选⑤;
Ⅲ.向NaAlO2溶液中通入CO2发生反应:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,CO2过量,CO32-和CO2以及水反应生成HCO3-,不影响沉淀的量,故选⑥;
Ⅳ. 向含NaOH的澄清石灰水中通入CO2,依次发生反应:①CO2+Ca(OH)2=CaCO3↓+H2O②CO2+2NaOH=Na2CO3+H2O③ CO2+H2O+CO32-=2HCO3-④CO2+H2O+CaCO3=Ca(HCO3)2。CO2的通入,开始就有沉淀生成,到沉淀最大量时,发生反应③CO2+2NaOH=Na2CO3+H2O和④CO2+H2O+CO32-=2HCO3-,所以沉淀的量有一段是不随CO2的通入而变化的然后再通CO2,沉淀的量才会减少,所以③图不能代表向含NaOH的澄清石灰水中通入CO2。


科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是()
A.H2O与BeCl2为V形B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形D.SO3与CO32-为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、硫酸钠以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1)第⑤步中,操作B是___(填操作名称),第④步中,试剂Y是___。
(2)判断试剂X过量的方法是___。
(3)写出第②步中涉及反应的化学方程式___。
(4)第⑤步操作中得到的固体成分有:泥沙、CaCO3、Mg(OH)2、___(填化学式)。
(5)此实验方案尚需完善,具体步骤是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有部分被氧化了的Fe-Cu合金样品(氧化产物Fe2O3、CuO)5.76g,经如下处理:

下列说法正确的是( )
A.滤液A中的阳离子Fe2+ 、Fe3+、H+B.样品Fe元素的质量为2.24g
C.样品CuO的质量4.0gD.V=336
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是( )

A.用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠溶液中可观察到有大量白色沉淀产生
B.利用装置③可制备氢氧化亚铁并长时间观察其颜色
C.装置④不能验证Na2CO3和NaHCO3两种固体的热稳定性
D.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
高锰酸钾(![]() )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
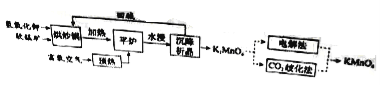
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既是化合反应,又是氧化还原反应的是( )
A.铁和氯气反应:2Fe+3Cl2![]() 2FeC13
2FeC13
B.生石灰与水反应:CaO+H2O=Ca(OH)2
C.氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
D.氯气通入溴化钠溶液:C12+2NaBr=2NaCl+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水中的电离方程式书写正确的是( )
A.H2CO3![]() 2H++CO32-B.Al(OH)3=Al3+ +3OH-
2H++CO32-B.Al(OH)3=Al3+ +3OH-
C.NH3·H2O![]() NH4+ +OH-D.NaHSO4=Na++HSO4-
NH4+ +OH-D.NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+] |
B.[Na+]=[Cl-]>[H+]>[OH-] |
C.[Na+]=[Cl-]>[OH-]>[H+] |
D.[Cl-]>[Na+]>[OH-]>[H+] |
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1______C2(填“<”、“=”或“>”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com