
| A. | $\frac{1000A}{22.4}$ | B. | $\frac{1000Aρ}{17A+22.4B}$mol/L | ||
| C. | $\frac{A}{22.4}$mol/L | D. | $\frac{1000ρ}{17A+22.4B}$mol/L |
分析 根据n=$\frac{V}{{V}_{m}}$、m=nM计算出氨气的物质的量、质量,再根据氨气的质量、水的质量计算出溶液质量,然后根据溶液质量、溶液密度及表达式V=$\frac{m}{ρ}$计算出溶液体积,最后根据c=$\frac{n}{V}$计算出此氨水的物质的量浓度.
解答 解:A L氨气的物质的量为:n(NH3)=$\frac{AL}{22.4L/mol}$=$\frac{A}{22.4}$mol,
氨气的质量为:m(NH3)=17g/mol×$\frac{A}{22.4}$mol=$\frac{17A}{22.4}$g,
BmL水的质量约为Bg,则所得氨水溶液的质量为:$\frac{17A}{22.4}$g+B g,
所得溶液的体积为:V=$\frac{\frac{17A}{22.4}+B}{1000ρ}$=$\frac{17A+22.4B}{22400ρ}$L,
则此氨水的物质的量浓度为:c(NH3)=$\frac{1000Aρ}{17A+22.4B}$mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,特别需要明确:计算溶液体积时,需要根据溶液的质量、溶液的密度进行计算,不能直接利用气体的体积计算.


科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气在光照条件下发生加成反应 | |
| B. | 甲烷和乙烯都可以与氯气反应,反应类型不同 | |
| C. | 蔗糖、油脂、蛋白质都可以水解 | |
| D. | 乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24L己烷分子中含1.9NA对共用电子 | |
| B. | 常温下4.4g的CO2和N2O混合物中,所含有的原子数为0.3 NA | |
| C. | 0.1mol Fe与0.1 mol Cl2反应时失电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g 电路中就转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
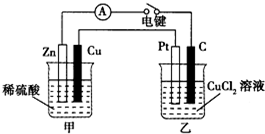 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
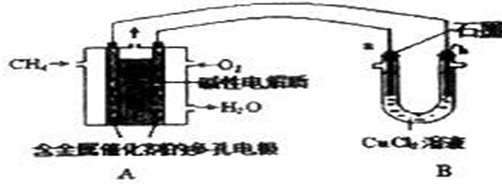
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
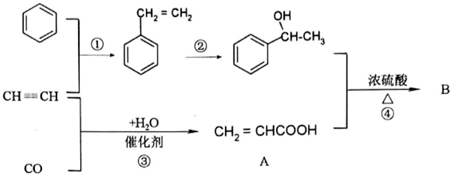
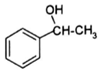 +CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$
+CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$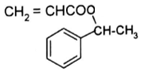 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学实验室中的蔗糖纯度很高,可用来食用 | |
| B. | 实验室中制取完有毒气体,开窗通风即可 | |
| C. | 为了节约用水,实验室中用过的废洗液,可以用来冲洗厕所 | |
| D. | 不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu能与浓硝酸反应,但不能与浓盐酸反应 | |
| B. | Cu与浓硝酸反应比与稀硝酸反应快 | |
| C. | N2与O2在常温、常压下不反应,放电时可反应 | |
| D. | Fe与浓盐酸反应比与稀盐酸反应快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com