某兴趣小组为验证日常生活用的火柴头上含有KclO
3、MnO
2、S,设计了如图1实验流程:
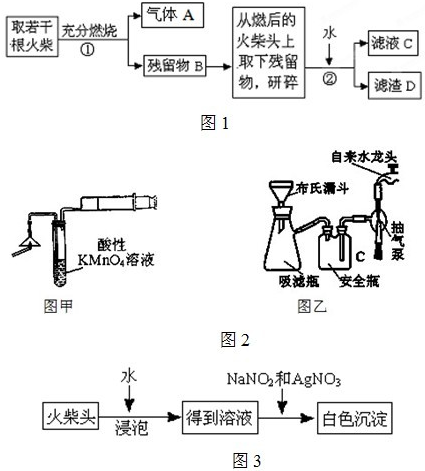
请回答以下问题:
(1)为验证气体A,按图2甲所示进行实验:若能观察到
KMnO4溶液(紫红色)褪色
KMnO4溶液(紫红色)褪色
的现象,即可证明火柴头上含有S元素.
(2)步骤②的实验操作装置如2乙所示,该操作的名称是
减压过滤
减压过滤
,其工作原理是
当找开自来水龙头,装置内部的空气随自来水被带走,导致装置内部压强减小,使过滤速度加快,得到较干燥的固体物质
当找开自来水龙头,装置内部的空气随自来水被带走,导致装置内部压强减小,使过滤速度加快,得到较干燥的固体物质
.
(3)要证明火柴头中含有Cl元素的后续实验步骤是
取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素
取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素
.
(4)有学生提出检验火柴头上KClO
3另一套实验方案(如图3):有关的离子反应方程式为
ClO3?+3NO2?+Ag+=AgCl↓+3NO3?
ClO3?+3NO2?+Ag+=AgCl↓+3NO3?
,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO
3的存在,其理由是
AgNO2与AgCl均为不溶于水的白色沉淀
AgNO2与AgCl均为不溶于水的白色沉淀
.
(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验.
| 实验次数 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
| ① |
30 |
5 |
0 |
85 |
2 |
3.8 |
| ② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
| ③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
| ④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
| ⑤ |
30 |
5 |
0 |
55 |
2 |
10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验
②
②
和
③
③
证明物质D的用量越大,反应速率越快.
(6)写出步骤①中发生反应的化学方程式
.













