
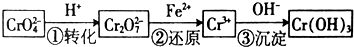
���� ��1�����������Ӷ�2CrO42-����ɫ��+2H+�TCr2O72- ����ɫ��+H2Oƽ���ƶ���Ӱ���жϣ�
��2������2CrO42-+2H+?Cr2O72-+H2O���ͼʾװ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7����Ҫͨ���������H+�����Һ�����ԣ�˵���ڸõ缫�����������ӵ�Դ����������bΪ����������������������ʧ���ӣ�
��3������������Cr2O72-����������ԭ��Ӧ����c��Fe3+����Ksp[Fe��OH��3]����c��OH-�������Ksp[Cr��OH��3]����c��Cr3+����
��4�����ݻ��ϼ�������������Լ�ԭ���غ������
��5�����������غ㶨�ɣ��ڱ仯�����У�Cr������û�б䣬�����ԭ�Ӻ�ԭ�ӵĸ����ȼ��ɣ�
��� �⣺��1����ƽ����ϵ��pH=0����Һ���Խ�ǿ��ƽ��2CrO42-����ɫ��+2H+�TCr2O72- ����ɫ��+H2O�����ƶ�����Һ�ʳ�ɫ��
�ʴ�Ϊ���ȣ�
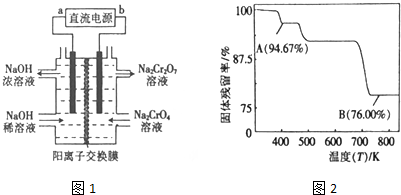
��2������2CrO42-+2H+?Cr2O72-+H2O���ͼʾװ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7����Ҫͨ���������H+�����Һ�����ԣ�˵���ڸõ缫�����������ӵ�Դ����������bΪ��������aΪ����������������������ʧ���ӣ��������缫��ӦʽΪ4OH--4e-=O2��+2H2O��
�ʴ�Ϊ��������4OH--4e-=O2��+2H2O��
��3������������Cr2O72-����������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O��
���Ӧ�����Һ��һ����NaOH������Һ��c��Fe3+��=2.0��10-12mol•L-1����c��OH-��=$\root{3}{\frac{4.0��1{0}^{-38}}{2.0��1{0}^{-12}}}$mol/L����c��Cr3+��=$\frac{6.0��1{0}^{-31}}{2.0��1{0}^{-26}}$=3��10-5��
�ʴ�Ϊ��6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O��3��10-5��
��4��CrO3����ǿ�����ԣ������л����ƾ���ʱ���Ҵ������������ᣬ̼��ƽ�����ϼ۴�-2�����ߵ�0��1���Ҵ����ϼ۱仯4��CrO3����ԭ����ɫ�������[Cr2��SO4��3]�����Ļ��ϼ۴�+6�۽��͵�+3�ۣ�1��CrO3���ϼ۱仯3�����ߵ���С��������12���ٸ���ԭ���غ��4CrO3+3C2H5OH+6H2SO4=2Cr2��SO4��3+3CH3COOH+9H2O����b��c��f=1��2��3��
�ʴ�Ϊ��1��2��3��
��5�����������Ϊ100g��B��ʱ���������Ϊ��100g��76%=76g��Cr������û�б䣬������������Cr������Ϊ52g����Ԫ�ص�����Ϊ16�����ߵĸ�����Ϊ$\frac{52}{52}$��$\frac{24}{16}$=2��3������B��ʱʣ�����ijɷ���Cr2O3�����Լ��ȵ� 750K ʱ�ɷ���Cr2O3��
�ʴ�Ϊ��Cr2O3��
���� �����ۺϿ����˻�ѧƽ��ԭ����������ԭ��Ӧ�����ӷ���ʽ����д�������ܽ�ƽ���Ksp���йؼ�������ݣ������ڷ�Ӧԭ����Ӧ�õĿ��飬����ʱҪ���������Ϣ��������ԭ�����н����Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��ʵ�����У�������̼�����ơ��Ȼ��ơ��Ȼ�淋������ܽ�ȵIJ��죬ͨ������ʳ��ˮ�����Ͷ�����̼��Ӧ�����̼�����ƾ��壬��Ӧԭ���������»�ѧ����ʽ��ʾ��NH3+CO2+NaCl+H2O�TNH4Cl+NaHCO3�������ݴ�ԭ�������Ƶ�̼���ƾ��壬ijУѧ���������ͼʵ��װ�ã�����Bװ���е��Թ��������а����Ȼ��Ƶ���Һ���Ҷ��߾��Ѵﵽ���ͣ�
��ʵ�����У�������̼�����ơ��Ȼ��ơ��Ȼ�淋������ܽ�ȵIJ��죬ͨ������ʳ��ˮ�����Ͷ�����̼��Ӧ�����̼�����ƾ��壬��Ӧԭ���������»�ѧ����ʽ��ʾ��NH3+CO2+NaCl+H2O�TNH4Cl+NaHCO3�������ݴ�ԭ�������Ƶ�̼���ƾ��壬ijУѧ���������ͼʵ��װ�ã�����Bװ���е��Թ��������а����Ȼ��Ƶ���Һ���Ҷ��߾��Ѵﵽ���ͣ�| 0�� | 10�� | 20�� | 30�� | 40�� | 50�� | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
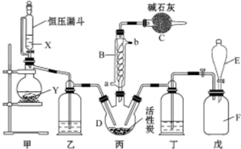 �����ȣ�SO2Cl2����һ����Ҫ���л��ϳ��Լ���ʵ���ҿ�����SO2��Cl2��Ӧ��ȡ������SO2Cl2��װ����ͼ����Щ�г�װ��ʡ�ԣ���ʾ����֪SO2Cl2���۵�Ϊ-54.1�棬�е�Ϊ69.1�棬��ˮ�ܷ������ҵ�ˮ�ⷴӦ��������������
�����ȣ�SO2Cl2����һ����Ҫ���л��ϳ��Լ���ʵ���ҿ�����SO2��Cl2��Ӧ��ȡ������SO2Cl2��װ����ͼ����Щ�г�װ��ʡ�ԣ���ʾ����֪SO2Cl2���۵�Ϊ-54.1�棬�е�Ϊ69.1�棬��ˮ�ܷ������ҵ�ˮ�ⷴӦ���������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ѡ���Լ�������ţ� | ʵ������ | |
| ����1 | ||
| ����2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ܢڢݢ� | B�� | �ܢ٢ڢݢ� | C�� | �ڢݢܢ٢� | D�� | �ڢܢ٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com