
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
科目:高中化学 来源: 题型:
【题目】在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2O) | n(CO2) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+I2(g)![]() 2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
A. 甲、乙提高相同温度 B. 甲中加入0.1molHe,乙中不变
C. 甲降低温度,乙增大压强 D. 甲增加0.1molH2,乙增加0.1molI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 。在
。在![]() 的密闭容器中进行模拟合成实验,将
的密闭容器中进行模拟合成实验,将![]() 和
和![]() 通入容器中,分别在
通入容器中,分别在![]() 和
和![]() 反应,每隔一段时间测得容器中的甲醇的浓度如下:
反应,每隔一段时间测得容器中的甲醇的浓度如下:
| 10 | 20 | 30 | 40 | 50 | 60 |
300 | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
下列说法正确的是 ![]()
![]()
A.![]() 时,开始
时,开始![]() 内
内![]() 的平均反应速率
的平均反应速率![]()
B.反应达到平衡时,两温度下CO和![]() 的转化率之比均为
的转化率之比均为![]()
C.![]() 反应达到平衡时,放出的热量为
反应达到平衡时,放出的热量为![]()
D.![]() 时,若容器的容积压缩到原来的
时,若容器的容积压缩到原来的![]() ,则
,则![]() 增大,
增大,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在化工生产中有着广泛的应用,请对下列问题作答。
![]() 有多种单质,其中一种叫白磷,分子式为
有多种单质,其中一种叫白磷,分子式为![]() ,结构如图Ⅱ所示,
,结构如图Ⅱ所示,![]() 分子的活泼性比
分子的活泼性比![]() 分子______
分子______![]() 填强或弱
填强或弱![]() 。
。
![]() 白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设
白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设![]() 、
、![]() 、
、![]() 的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出
的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出![]() 的键能的表达式为______
的键能的表达式为______

![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
![]() 可用于化学镀镍。配平并完成下列化学方程式:
可用于化学镀镍。配平并完成下列化学方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
![]() 磷酸是一种三元中强酸,已知
磷酸是一种三元中强酸,已知![]() ,
,![]() ,
,![]() ,
,![]() 的水溶液显______性,解释原因______。
的水溶液显______性,解释原因______。
![]() 是重要的化工原料,某温度下,反应
是重要的化工原料,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,在1L的密闭容器中加入
,在1L的密闭容器中加入![]() ,平衡后
,平衡后![]() 的浓度是______。
的浓度是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中发生反应:![]() 下列说法不正确的是
下列说法不正确的是
A.该反应的平衡常数表达式: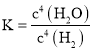
B.若容器内气体的压强保持不变,说明该反应已达到平衡状态
C.若![]() 足量,改变起始充入
足量,改变起始充入![]() 的浓度,达平衡时
的浓度,达平衡时![]() 的转化率不变
的转化率不变
D.经2min后,![]() 浓度下降了
浓度下降了![]() 则反应速度为
则反应速度为![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列各组离子一定能在指定环境中大量共存的是( )
A.在c(H+)=10-10 mol/L的溶液中 Al3+ 、NH![]() 、Cl- 、NO
、Cl- 、NO![]()
B.pH值为13的溶液 K+ 、SO![]() 、Na+、S2-
、Na+、S2-
C.水电离出来的c(H+)=10-12mol/L的溶液 K+、NH4+、Cl-、ClO-
D.甲基橙呈红色的溶液中 Fe3+、Na+ 、SO42-、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 此时刻正反应速率大于逆反应速率
B. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. a=1.64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CaSO4代替O2与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图1所示。
燃烧器中反应① 1/4CaSO4(s) + H2(g) = 1/4CaS(s) + H2O(g) △H1 (主反应)
反应② CaSO4(s) + H2(g) = CaO(s) + SO2(g)+ H2O(g) △H2 (副反应)
再生器中反应:1/2 CaS(s) + O2(g) = 1/2CaSO4(s) △H3

(1)气化反应器中发生反应的化学方程式是_____________________。
(2)燃烧器中SO2物质的量分数随温度T、压强p (MPa)的变化曲线见图2,从图2中可以得出三条主要规律:
①其他条件不变,温度越高,SO2含量越高;
②________________________________________________________;
③_________________________________________________________;
由图2,为减少SO2的排放量,可采取的措施是______________________。
(3)该燃烧技术中可循环的物质除CaSO4、CaS外,还有_________(写名称)。
(4)在一定条件下,CO可与甲苯反应,在其苯环对位上引入一个醛基,产物的结构简式为___________。
(5)欲采用氯化钯(PdCl2)溶液除去H2中的CO,完成以下实验装置图:
(注:CO + PdCl2 + H2O = CO2+ Pd + 2HCl)______________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com