
| A. | 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 | |
| B. | 0.1 mol•L-1醋酸溶液中:c2(H+)=c(H+)•c(CH3COO-)+KW | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)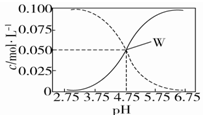 | |
| D. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
分析 A.强碱弱酸盐发生水解以及电荷守恒来分析判断;
B.0.1mol•L-1某一元弱酸溶液中:c(H+)2=c(H+)•c(CH3COO-)+KW,整理可得:c(H+)=c(CH3COO-)+$\frac{Kw}{c({H}^{+})}$=c(CH3COO-)+c(OH-),该关系满足电荷守恒;
C.由图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点时c(CH3COOH)=c(CH3COO-);
D.常温下两溶液反应后呈中性,则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,据此结合醋酸的电离平衡常数表达式计算.
解答 解:A.醋酸是弱酸,所以CH3COONa溶液中发生水解反应:CH3COO-+H2O?CH3COOH+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中c(Na+)+c(H+)大于CH3COONa溶液中c(Na+)+c(H+),根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得CH3COONa溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于CH3COONa溶液,即:N前<N后,故A错误;
B.该一元弱酸溶液中满足:c(H+)2=c(H+)•c(CH3COO-)+KW,方程式两同时除以氢离子浓度可得:c(H+)=c(CH3COO-)+$\frac{Kw}{c({H}^{+})}$=c(CH3COO-)+c(OH-),根据HA溶液中的电荷守恒可知:c(H+)=c(CH3COO-)+c(OH-),故B正确;
C.由图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点时c(CH3COOH)=c(CH3COO-),所以当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-),故C正确;
D.反应后溶液呈中性,则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,
根据物料守恒,反应后溶液中醋酸的浓度为:($\frac{c}{2}$-0.1)mol/L,
所以用含c的代数式表示CH3COOH的电离常数为:Ka=$\frac{1{0}^{-7}×0.01}{\frac{c}{2}-0.01}$=$\frac{2×1{0}^{-9}}{c-0.02}$,故D正确;
故选A.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,注意掌握盐的水解原理、酸碱混合的定性判断方法,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小.


科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 无色溶液中滴加氯水和CC14,振荡、静置 | 下层溶液呈紫色 | 原溶液中有I- |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水高温下反应 |
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H3+的电子式为 | |
| B. | H3+可进行反应,在液态氢中形成H4+、H6+、H8+ | |
| C. | H3+可在液态氢中形成H5+、H7+、H9+ | |
| D. | H3+广泛存在于固态、液态和气态氢中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有7个主族,7个副族,共14个纵行 | |
| B. | 氮元素位于第二周期第三主族 | |
| C. | 金属性最强的元素是Li | |
| D. | 非金属性最强的元素是F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com