
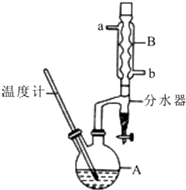
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不容 |
分析 (1)步骤①中浓硫酸和正丁醇的添加顺序类似浓硫酸的稀释,注意防止酸液飞溅;
(2)使冷凝管充分冷凝水,进行充分冷却;
(3)用水可以溶解浓硫酸;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小于水在上层;
(4)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化;
(5)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,在分水器中会分层,密度小的在上层;
(6)根据正丁醇的质量计算正丁醚的理论产量,样品产率=(实际产量÷理论产量)×100%.
解答 解:(1)因为浓硫酸的密度大,应将浓硫酸加到正丁醇中,防止发生迸溅,
故答案为:正丁醇;
(2)采取逆流原理通入冷凝水,使冷凝管充分冷凝水,进行充分冷却,即从b口通入冷凝水,
故答案为:b;
(3)在反应混合物中,浓硫酸能溶解于水,正丁醚不溶,正丁醇微溶于水,所以步骤③的目的是初步洗去浓硫酸;分液漏斗中振荡静置后,上层液体中为密度比水小的正丁醚和正丁醇,从分液漏斗的上口倒出,
故答案为:浓H2SO4;上;
(4)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化,加热蒸馏时应收集142℃左右的馏分,
故答案为:D;
(5)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,密度小于水,在分水器中会分层,正丁醇在上层,水在下层,
故答案为:正丁醇;水;
(6)由2CH3CH2CH2CH2OH  CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为$\frac{37g}{74g/mol}$×$\frac{1}{2}$×130g/mol=32.5g,故样品产率为(11g÷32.5g)×100%=34%,
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为$\frac{37g}{74g/mol}$×$\frac{1}{2}$×130g/mol=32.5g,故样品产率为(11g÷32.5g)×100%=34%,
故答案为:34%.
点评 本题考查有机物的制备实验,为高考常见题型和高频考点,侧重考查物质分离提纯、对原理与操作的分析评价、产率计算等,题目偏重于关注基础考查,中等难度.


科目:高中化学 来源: 题型:实验题

| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | - | 0.795 | 易溶于水 |
| 乙醚 | 34.5 | - | 0.7138 | 难溶于水 |
| 3,5-二甲氧基苯酚 | 172 | 36 | - | 易溶于甲醇、乙醚、微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
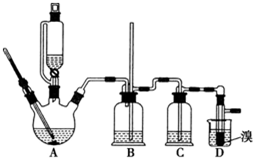 实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
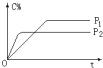 可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )| A. | P1>P2,n>3 | B. | P1>P2,n<3 | C. | P1<P2,n<3 | D. | P1<P2,n>3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
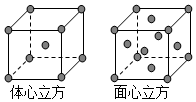 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com