
分析 (1)碳酸钾与氯化钙反应生成碳酸钙沉淀,氯化钾与氯化钙不反应;
(2)氧化铝与氢氧化钠溶液反应生成可溶性偏铝酸钠溶液,氧化铁不反应;
(3)碳酸氢钠不稳定受热分解生成碳酸钠和水,二氧化碳;
(4)①铝与氢氧化钠反应生成偏铝酸钠和氢气;
②氯化铁与铁反应生成氯化亚铁;
③氯化亚铁与氯气反应生成氯化铁;
(5)二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳而被吸收.
解答 解:(1)碳酸钾与氯化钙反应生成碳酸钙沉淀,离子方程式:Ca2++CO32-=CaCO3↓,氯化钾与氯化钙不反应,二者现象不同,可用氯化钙溶液鉴别;
故答案为:氯化钙;Ca2++CO32-=CaCO3↓;
(2)氧化铝与氢氧化钠溶液反应生成可溶性偏铝酸钠溶液,离子方程式:Al2O3+2OH-=AlO2-+2H2O,氧化铁不反应,过滤反应后混合物可以分离氧化铁;
故答案为:氢氧化钠溶液;Al2O3+2OH-=AlO2-+2H2O;
(3)碳酸氢钠分解生成碳酸钠和水、二氧化碳,方程式:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑,所以通过加热可以除去NaCO3粉末中混入的NaHCO3杂质;
故答案为:加热;2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑;
(4)①铝与氢氧化钠反应生成偏铝酸钠和氢气,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
②氯化铁与铁反应生成氯化亚铁,离子方程式:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
③氯化亚铁与氯气反应生成氯化铁,离子方程式:2Fe2++Cl2=2Cl-+2Fe2+;
故答案为:2Fe2++Cl2=2Cl-+2Fe2+;
(5)二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳而被吸收,所以可以用饱和碳酸氢钠除去氯化氢,离子方程式:
H++HCO3-=H2O+CO2↑,
故答案为:饱和碳酸氢钠溶液;H++HCO3-=H2O+CO2↑;
点评 本题考查了物质的提纯,侧重考查离子方程式的书写,明确物质的性质及发生的反应是解题关键,注意除杂不能引入新杂质,题目难度中等.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、H+、Na+、NO3- | B. | H+、Ag+、Cl-、SO42- | ||
| C. | K+、Na+、OH-、NO3- | D. | Ba2+、Ca2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF能用于刻蚀玻璃,制作玻璃量筒刻度 | |
| B. | SiO2是制光导纤维的主要原料 | |
| C. | 硅酸可由SiO2直接制得 | |
| D. | SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有乙烷 | D. | 一定有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
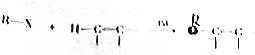
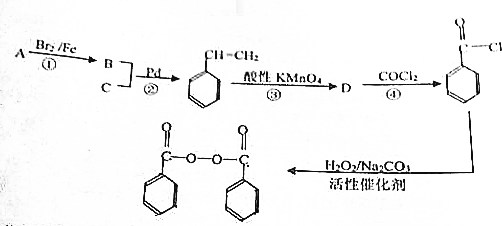
 ,物质D中含有的官能团的名称为羧基.
,物质D中含有的官能团的名称为羧基. ;
;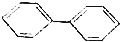 );
);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2,NaOH,NaHCO3 | B. | Na2CO3,MgCl2,H2SO4 | ||
| C. | AgNO3,HCl,NaOH | D. | Ba(OH)2,CaCl2,Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH | |
| D. | 电解精炼铜时,杂质银变成银离子进入溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com