
【题目】高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:
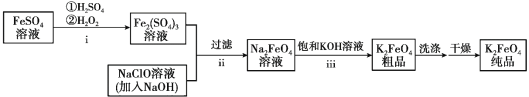
①i中反应的离子方程式是_______。
② 将ii中反应的离子方程式补充完整:____Fe3+ +____OH- +____ClO-=____FeO42-+_______+________
③ iii中反应说明溶解度:Na2FeO4_______K2FeO4(填“>”或“< ”)。
(2)K2FeO4的性质:
i. 将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ii. 将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii. 将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快。
① K2FeO4溶于蒸馏水的化学反应方程式是_______。
② K2FeO4的氧化性与溶液pH的关系是_______。
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:
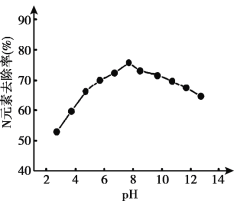
① K2FeO4脱氮的最佳pH是_____。
② 根据图推测,pH = 4时生活垃圾渗透液中含氮物质主要以______形式存在。
③ pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:_______。
【答案】2Fe2+ +H2O2 + 2H+ = 2Fe3+ + 2H2O 2 10 3 2 3Cl- 5H2O > 4K2FeO4 +10H2O = 4Fe(OH)3(胶体) + 3O2↑ + 8KOH pH越小,氧化性越强 pH≈8 NH4+ pH>8的溶液,随pH增大,K2FeO4氧化性减弱,不利于将含氮物质氧化
【解析】
将硫酸亚铁与酸性过氧化氢溶液反应,得到硫酸铁,硫酸铁与氢氧化钠和次氯酸钠发生氧化还原反应,得到高铁酸钠,再加入氢氧化钾,可以到到高铁酸钾;
(1)①i中是2Fe2+ 和酸性H2O2溶液发生氧化还原反应;
②根据电荷守恒和元素守恒完成并配平离子方程式;
③ iii中由高铁酸钠溶液转化为高铁酸钾粗品,说明溶解度减小;
(2)①根据K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应的现象,完成化学方程式。
②根据将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快的现象,得出pH越小,氧化性越强;
(3)①根据图像,pH≈8时,K2FeO4脱氮率最高;
②图像可以得出,pH = 4时,氮元素的去除率为百分之六十,生活垃圾渗透液的脱氮(将含氮物质转化为N2)生活垃圾中的含氮物质为NH4+;
③由于pH越小,高铁酸钾的氧化性越强,则PH增大,会使高铁酸钾的氧化性减弱;
将硫酸亚铁与酸性过氧化氢溶液反应,得到硫酸铁,硫酸铁与氢氧化钠和次氯酸钠发生氧化还原反应,得到高铁酸钠,再加入氢氧化钾,可以到到高铁酸钾;
(1).①i中是2Fe2+ 和酸性H2O2溶液发生氧化还原反应,2Fe2++H2O2+2H+ =2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②根据电荷守恒和元素守恒完成并配平离子方程式, 2Fe3+ +10OH- +3ClO-=2FeO42-+ 3Cl- +5H2O,
故答案为:2;10;3;2;3Cl-;5H2O;
③iii中由高铁酸钠溶液转化为高铁酸钾粗品,说明溶解度减小,
故答案为:>;
(2).①将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应根据现象写出化学方程式4K2FeO4 +10H2O = 4Fe(OH)3(胶体) + 3O2↑ + 8KOH,
故答案为:4K2FeO4 +10H2O = 4Fe(OH)3(胶体) + 3O2↑ + 8KOH;
②根据将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快的现象,得出pH越小,氧化性越强,
故答案为:pH越小,氧化性越强;
(3).①根据图像,pH≈8时,K2FeO4脱氮率最高,
故答案为:pH≈8;
②图像可以得出,pH = 4时,氮元素的去除率为百分之六十,生活垃圾渗透液的脱氮(将含氮物质转化为N2)生活垃圾中的含氮物质为NH4+,
故答案为:NH4+;
③由于pH越小,高铁酸钾的氧化性越强,则PH增大,会使高铁酸钾的氧化性减弱,
故答案为:pH>8的溶液,随pH增大,K2FeO4氧化性碱弱,不利于将含氮物质氧化;


科目:高中化学 来源: 题型:
【题目】A、B、C三种短周期元素,它们在周期表中的位置如图:
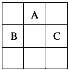
A原子核内质子数和中子数相等;B、C两元素原子核外电子数之和是A原子质量数的2倍。则:
(1)元素名称为A________、B________、C________。
(2)B和C最高价氧化物对应的水化物的化学式是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是
A. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B. 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br+2Cl2=2Fe3++Br2+4Cl
C. 向明矾溶液中滴加Ba(OH)2,恰好使![]() 沉淀完全:2Al3++3
沉淀完全:2Al3++3![]() +3Ba2++6OH=2A1(OH)3↓+3BaSO4↓
+3Ba2++6OH=2A1(OH)3↓+3BaSO4↓
D. 向碳酸钠溶液中滴加过量的稀硫酸:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)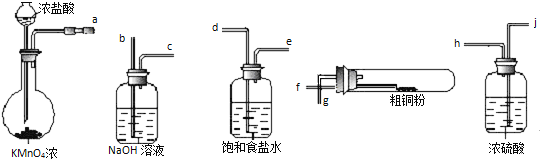
①按气流方向连接各仪器接口顺序是:![]() ______ .
______ .
②反应时,盛粗铜粉的试管中的现象是 ______ .
③已知:氯化铜溶液中有如下转化关系:
![]()
![]()
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 ______ ![]() 填序号
填序号![]() .
.
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入![]() 晶体,溶液变为绿色
晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气持续通入紫色石蕊试液中,溶液颜色呈现如下变化:
![]()
关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是( )
A.H+、ClO-、Cl2B.H+、ClO-、Cl-C.HCl、ClO-、Cl-D.H+、HClO、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列过程与氧化还原反应无关的是( )
A.酸性重铬酸钾用于检测酒精
B.铝粉与强碱溶液反应放热
C.植物油在空气中变质,产生“哈喇”味
D.海水经风吹日晒获得粗盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是
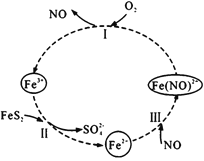
A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ш是氧化还原反应
D.黄铁矿催化氧化中NO作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如下。
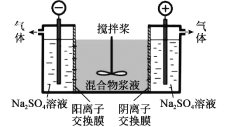
下列说法不正确的是( )
A.阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
B.CrO42-通过阴离子交换膜进入阳极室,从而实现与浆液的分离
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.适当增大电压,CrO42-也可在阴极室转化为Cr(OH)3除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径X<W
B. 对应气态氢化物的稳定性Y<Z
C. 化合物XZW既含离子键也含共价键
D. Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com