
| A. | 煤的干馏和石油的分馏都属于化学变化 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝 | |
| D. | 铝制容器不宜用来长时间存放酸性和碱性食物,也不可长时间存放含盐腌制食品 |
分析 A.分馏利于混合物的沸点不同分离混合物;
B.绿色化学的核心从源头上减少污染物的使用;
C.淀粉遇碘变蓝;
D.Al与酸、碱均反应.
解答 解:A.分馏利于混合物的沸点不同分离混合物,为物理变化,只有煤的干馏为化学变化,故A错误;
B.绿色化学的核心从源头上减少污染物的使用,而不能先污染后治理,故B错误;
C.淀粉遇碘变蓝,食盐中为碘酸钾,则不能检验,故C错误;
D.Al与酸、碱均反应,则铝制容器不宜用来长时间存放酸性和碱性食物,也不可长时间存放含盐腌制食品,故D正确;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>H2S | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 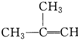 -CH3+Br2→ -CH3+Br2→ | |
| B. | CH2=CH-CH3+HCl→ | |
| C. | CH2=CH-CH=CH2+Br2→ | |
| D. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 从海水可获得在常温下为液体的单质是Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+不能与SCN-形成血红色化合物 | B. | 该晶体中一定含有SCN- | ||
| C. | Fe3+的氧化性比氯气的氧化性强 | D. | Fe2+被氯气氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇、2-丙醇 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 煤的干馏是现今获得芳香烃的主要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
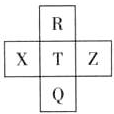 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 单质的沸点:T>Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:T<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

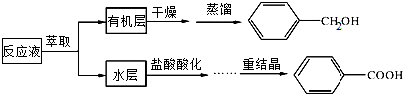
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com