
【题目】下列热化学方程式及有关应用的叙述中,不正确的是
A.在同温同压下,热化学方程式2H2(g)+O2(g)==2H2O(l)ΔH1;2H2(g)+O2(g)==2H2O(g)ΔH2,反应热ΔH1ΔH2
B.已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l)△H-57.3kJmol-1
BaSO4(s)+H2O(l)△H-57.3kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,则:N2(g)+3H2(g)![]() 2NH3(g)△H-38.6kJmol-1
2NH3(g)△H-38.6kJmol-1
D.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)═CO(g)+2H2O(l)△H=-890.3kJmol-1
O2(g)═CO(g)+2H2O(l)△H=-890.3kJmol-1
科目:高中化学 来源: 题型:
【题目】MnO在医药、有机合成、电化学等领域用途广泛,易被氧化。某化学兴趣小组利用MnO2和炭粉制备MnO并检验可能的气态产物,利用如图所示装置进行实验。

已知:
i.CO与PdCl2溶液反应生成黑色难溶于水的Pd单质和两种常温下为气态的酸性物质。
ii.实验室常用亚硝酸钠晶体与饱和氯化铵溶液反应制备N2。
请回答下列问题:
(1)按气流从左到右的方向,上述装置的合理连接顺序为c→___→j(填仪器接口的小写字母)。
(2)实验开始时,应先点燃装置B处酒精灯一段时间后,再点燃装置A处酒精喷灯,原因为___(答两点)。
(3)充分反应后,能证明气态产物只有CO的现象为___。
(4)装置C中发生反应的化学方程式为___。
(5)装置F的作用为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是一种重要的化工原料。工业上常以CO和H2的混合气体为原料制备甲醇,其反应方程式为CO+2H2CH3OH。
(1)一定条件下向2 L的密闭容器中通入一定量的CO和H2使其发生上述反应,n(CO)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 1.0 | 0.8 | 0.5 | 0.25 | 0.20 | 0.20 |
①平均反应速率最大的时间段:___________min(填 “0~1”、“1~2” 、“2~3”“3~4”或“4~5”)。
②从反应开始到3 min末,氢气的平均反应速率v(H2)=______________mol·L-1·min-1
③能够判断该反应达到平衡的是________(填字母) 。
a.v逆(CO)=2v正(H2)
b.CO、H2和CH3OH三种物质的浓度相等
c.CH3OH分解的速率和CH3OH生成的速率相等
d.相同时间内消耗1molCO,同时消耗1molCH3OH
④工业上用CO和H2为原料制备甲醇的过程中,会有副产物二甲醚(CH3OCH3)生成,写出该反应的化学方程式:__________.
(2)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气、KOH溶液构成,电池总反应为2CH3OH+3O2+4OH-=2![]() + 6H2O,其装置图下图所示。
+ 6H2O,其装置图下图所示。
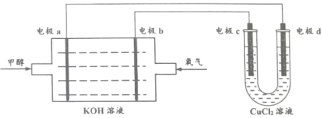
①电极a为电池的_______(填 “正极”或“负极”)
②电极b的电极反应式:________。
③电极C的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知乙烯能发生以下转化:
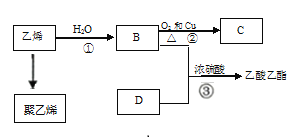
(1)写出化合物中的官能团的化学式或名称:B中所含官能团名称_;D中所含官能团化学式__;
(2)写出反应的化学方程式:
①_____________________, 反应类型:_____________;
②_____________________ , 反应类型:_____________;
③_____________________ , 反应类型:_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语正确的是
①甲基的电子式![]() ②Cl-的结构示意图
②Cl-的结构示意图![]() ③苯的结构简式C6H6 ④中子数为20的氯原子
③苯的结构简式C6H6 ④中子数为20的氯原子![]() ⑤乙酸分子的比例模型
⑤乙酸分子的比例模型![]() ⑥H2O2的电子式
⑥H2O2的电子式![]()
A.④B.③④⑤C.④⑤⑥D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针 |
1 | Mg、Al | 稀盐酸 | 偏转 |
2 | Al、Cu | 稀盐酸 | 偏转 |
3 | Al、C(石墨) | 稀盐酸 | 偏转 |
4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
5 | Al、Zn | 浓硝酸 | 偏转 |
下列回答错误的是
A.实验1、2中铝所作的电极(正极或负极)不相同
B.实验2、3,铝电极的电极反应式均为Al-3e-=Al3+
C.实验4中铝电极的电极反应式为Al-3e-+4OH-=![]() +2H2O
+2H2O
D.实验5中铝始终作原电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
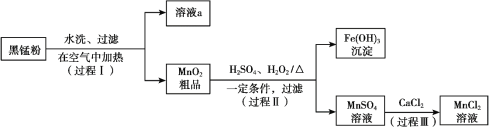
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶炼铝的原料,其工艺流程如下图所示:

请回答下列问题。
(1)操作1、2、3的名称均为__________。
(2)滤液1中所含的阴离子除OH-外,还有________、_______(填离子符号),滤渣2 的成份为_________(填化学式)。
(3)滤液2中加入过量氨水生成固体1的离子反应方程式为_________。
(4)滤液3中溶质的主要成份属于盐类的物质是_______、________(填化学式)。
(5)固体1灼烧发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
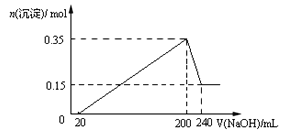
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com