
| A、铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、常温下浓硫酸能与铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸 |
| D、二氧化氯具有还原性,可用于自来水的杀菌消毒 |


科目:高中化学 来源: 题型:
| A、锌片溶解了32.5克 |
| B、锌片增重了32.5克 |
| C、铜片上放出了11.2L氢气 |
| D、铜片上放出了1mol氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.35mol/L |
| B、0.2mol/L |
| C、0.4mol/L |
| D、0.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
| B、为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次混合溶液的pH |
| C、常温下若强酸、强碱等体积中和后pH=7,则中和之前pH酸+pH碱=14 |
| D、在pH=12的某溶液中,水电离出的c(OH-)=10-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ds原子在周期表中位于第7周期第ⅦB族 |
| B、Ds是过渡元素 |
| C、Ds原子的核外排布为[Rn]5f146d87S2 |
| D、Ds原子的核外有110个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH固体 |
| B、NH4Cl固体 |
| C、H2SO4 |
| D、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
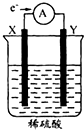 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A、外电路的电流方向为:X→导线→Y |
| B、若两电极都是金属,则它们的活动性顺序为X<Y |
| C、X极上发生的是还原反应,Y极上发生的是氧化反应 |
| D、溶液中的SO42-向X极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com