
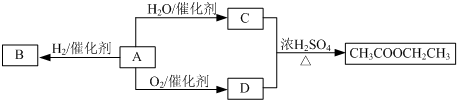
分析 C与D反应生成乙酸乙酯,则C、D分别为乙酸、乙醇中的一种,A与水反应生成C,A氧化生成D,且A与氢气发生加成反应生成B,可推知A为CH2=CH2,与水在一定条件下发生加成反应生成C为CH3CH2OH,乙烯氧化生成D为CH3COOH,乙烯与氢气发生加成反应生成B为CH3CH3.(4)中某烃X与B(乙烷)是同系物,分子中碳与氢的质量比为36:7,则C、H原子数目之比为$\frac{36}{12}$:$\frac{7}{1}$=3:7=6:14,故X为C6H14.
解答 解:C与D反应生成乙酸乙酯,则C、D分别为乙酸、乙醇中的一种,A与水反应生成C,A氧化生成D,且A与氢气发生加成反应生成B,可推知A为CH2=CH2,与水在一定条件下发生加成反应生成C为CH3CH2OH,乙烯氧化生成D为CH3COOH,乙烯与氢气发生加成反应生成B为CH3CH3.
(1)D为CH3COOH,含有的官能团为羧基,故答案为:羧基;
(2)A→B是乙烯与氢气发生加成反应生成乙醇,也属于还原反应,故选:BD;
(3)A→C反应的化学方程式:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;
(4)某烃X与B(乙烷)是同系物,分子中碳与氢的质量比为36:7,则C、H原子数目之比为$\frac{36}{12}$:$\frac{7}{1}$=3:7=6:14,故X为C6H14,
A.相同条件下,C6H14的密度比水小,故A正确;
B.C6H14的同分异构体有己烷、2-甲基戊烷、3-甲基戊烷、2,3-二甲基丁烷、2,2-二甲基丁烷,故B错误;
C.X为烷烃,不能与溴发生加成反应,故C错误;
D.发生取代反应得到溴代烃,与水不互溶,可以可通过加水确定试管2中的有机层是上层还是下层,故D正确,
故选:AD.
点评 本题考查有机物推断,涉及烯烃、醇、羧酸等性质与转化,根据乙酸乙酯的结构进行分析,侧重考查学生分析推理能力,难度不大.


科目:高中化学 来源: 题型:解答题
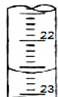 Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4H++4Cl-=Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
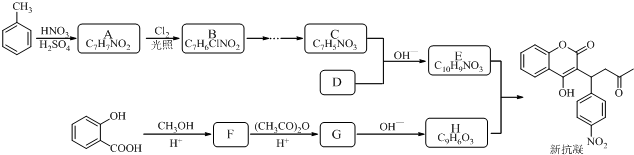
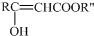
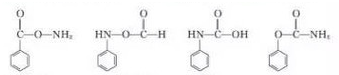
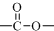 结构;
结构;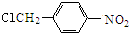 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$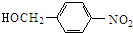 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$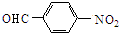
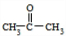 ;E
;E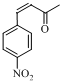
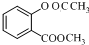 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$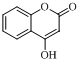 +CH3OH.
+CH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
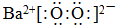 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液可能显中性或酸性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com