【答案】
分析:先根据信息推断元素.D的最外层有6个电子,所以最高价氧化物可表示为DO
3,氢化物可表示为H
2D,设D的相对
原子质量为x,根据D的最高价氧化物的相对分子质量与气态氢化物的相对分子质量之比为2.35:1可列式:
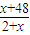
=2.35:1,
解得:x=32,因D原子核内质子数和中子数相等,所以D的质子数为16,为S元素;E原子的次外层有2 个电子且
最外层有4个电子,所以E为C元素;B最外层有3个电子,原子序数介于E和D之间,所以B为Al元素;A、B、C原子
的次外层都有8个电子且最外层分别有1、7个电子,所以A为K元素,C为Cl元素.
(1)摩尔质量和相对原子质量关系和核组成符号;
(2)K较活泼,先与水反应,再与硫酸铜溶液发生复分解反应,C与浓硫酸发生氧化还原反应;
(3)C、D、E三元素最高价氧化物对应水化物为:HClO
4、H
2SO
4、H
2CO
3,根据非金属性判断酸性强弱;
(4)氢氧化铝为两性氢氧化物,既能与酸反应又能与碱反应.
解答:解:先根据信息推断元素.D的最外层有6个电子,所以最高价氧化物可表示为DO
3,氢化物可表示为H
2D,设D的相对
原子质量为x,根据D的最高价氧化物的相对分子质量与气态氢化物的相对分子质量之比为2.35:1可列式:
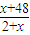
=2.35:1,
解得:x=32,因D原子核内质子数和中子数相等,所以D的质子数为16,为S元素;E原子的次外层有2 个电子且
最外层有4个电子,所以E为C元素;B最外层有3个电子,原子序数介于E和D之间,所以B为Al元素;A、B、C原子
的次外层都有8个电子且最外层分别有1、7个电子,所以A为K元素,C为Cl元素.
(1)当摩尔质量以g/mol为单位时数值上与相对原子质量相等,故答案为:32g/mol;
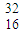
S;
(2)钾先与水发生置换反应:2K+2H
2O=2K
++2OH
-+H
2↑,KOH再与硫酸铜发生复分解反应:2OH
-+Cu
2+=Cu(OH)
2↓,
两式相加得总反应时:2K+2H
2O+Cu
2+=2K
++Cu(OH)
2+H
2↑.浓硫酸具有强氧化性,会把C氧化为二氧化碳,本身被还原为二氧化硫,反应为C+2H
2SO
4(浓)
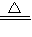
CO
2↑+2SO
2↑+2H
2O,
故答案为:2K+2H
2O+Cu
2+=2K
++Cu(OH)
2+H
2↑;C+2H
2SO
4(浓)
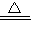
CO
2↑+2SO
2↑+2H
2O;?
(3)因非金属性Cl>S>C,所以酸性大小顺序为:HClO
4>H
2SO
4>H
2CO
3,故答案为:HClO
4>H
2SO
4>H
2CO
3;?
(4)氢氧化铝为两性氢氧化物,既能与强酸反应又能与强碱反应,B与A反应化学方程式为:Al(OH)
3+KOH═KAlO
2+2H
2O,
B与C反应方程式为:Al(OH)
3+3HClO
4═Al(ClO
4)
3+3H
2O,其离子方程式为Al(OH)
3+OH
-═AlO
2-+2H
2O、Al(OH)
3+3H
+═Al
3++3H
2O,
故答案为:Al(OH)
3+OH
-═AlO
2-+2H
2O;Al(OH)
3+3H
+═Al
3++3H
2O.
点评:本题考查学生利用原子结构的关系来推断元素,然后根据元素性质和元素周期律知识分析解答问题,推断元素是解答本题的难点,D元素的推断是关键.

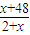 =2.35:1,
=2.35:1,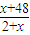 =2.35:1,
=2.35:1,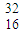 S;
S;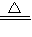 CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O,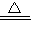 CO2↑+2SO2↑+2H2O;?
CO2↑+2SO2↑+2H2O;?












