
| A. | 5:3 | B. | 4:5 | C. | 5:4 | D. | 3:5 |
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
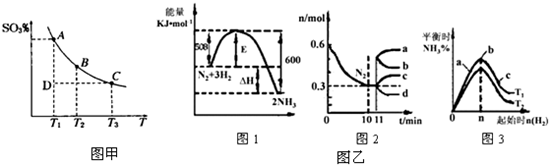
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易燃试剂与强氧化试剂分开放置并远离火源 | |
| B. | 金属钠易与空气、水等反应,当它着火时,用细沙覆盖灭火 | |
| C. | 在过滤操作中,要遵守“一贴”、“两低”、“三靠”原则 | |
| D. | 浓硝酸见光易分解,可以放在棕色广口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2比O3能量低,由O2变O3为放热反应 | |
| B. | 等质量的O2比O3能量高,由O2变O3为吸热反应 | |
| C. | O3比O2稳定,由O2变O3为放热反应 | |
| D. | O2比O3稳定,由O2变O3为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③ | C. | ①②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:1 | C. | 2:3 | D. | 1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com