

分析 Cu和FeCl3发生反应Cu+2FeCl3=2FeCl2+2CuCl2,所以废液中含有Cu2+、Fe2+,可能含有Fe3+,向废液中加入Fe粉,发生反应Cu2++Fe=Fe2++Cu,然后过滤,滤渣中含有Fe、Cu,滤液(Ⅰ)中含有FeCl2,向滤渣中加入过量稀盐酸,发生反应Fe+2HCl=FeCl2+H2,然后过滤,得到的滤渣是Cu,滤液(Ⅱ)中含有HCl、FeCl2,将滤液滤液(Ⅰ)、滤液(Ⅱ)混合,然后通入Cl2,发生反应2FeCl2+Cl2=2FeCl3,得到氯化铁溶液,以此解答该题.
解答 解:(1)Cu和FeCl3发生反应Cu+2FeCl3=2FeCl2+2CuCl2,反应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+,故答案为:Cu+2Fe3+=2Fe2++Cu2+;
(2)废液中含有Cu2+、Fe2+,可能含有Fe3+,为了从废液中回收铜,并重新制得纯净的FeCl3溶液,可向废液中加入Fe粉,发生反应Cu2++Fe=Fe2++Cu,然后过滤,滤渣中含有Fe、Cu,滤液(Ⅰ)中含有FeCl2,向滤渣中加入过量稀盐酸,发生反应Fe+2HCl=FeCl2+H2,然后过滤,得到的滤渣是Cu,滤液(Ⅱ)中含有HCl、FeCl2,将滤液滤液(Ⅰ)、滤液(Ⅱ)混合,然后通入Cl2,发生反应2FeCl2+Cl2=2FeCl3,得到氯化铁溶液,流程为 ,
,
故答案为: .
.
点评 本题考查物质分离和提纯,为高频考点,明确物质性质、物质反应先后顺序是解本题关键,注意Fe、Cu混合物和含有Fe3+、Cu2+混合溶液反应先后顺序,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3和Al3+ | B. | Al(OH)3 | ||
| C. | Al3+、Al(OH)3 和AlO2- | D. | 全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②③⑥ | C. | ②④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
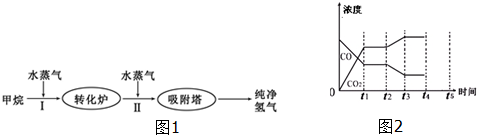
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

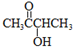 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 负极:Zn,电极反应:Zn-2e-═Zn2+.
负极:Zn,电极反应:Zn-2e-═Zn2+.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 每生成0.6mol H2,被还原的水分子数目为1.2NA | |
| B. | 有2.7g Al参加反应时,转移的电子数目为0.3NA | |
| C. | 有6.72L H2生成时,反应中转移的电子数目为0.6NA | |
| D. | 溶液中每增加0.1mol AlO${\;}_{2}^{-}$,Na+的数目就增加0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
(1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)| CH3COOH | H2CO3 | H2S | H3PO4 |
| K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com