
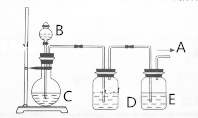
分析 (1)主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,根据信息探究同周期、周主族元素的化学性质的变化规律,C、N属于同一周期,C、Si属于同一主族,C、N、Si三种非金属元素的非金属性强弱比较,B和C是碳酸钙和稀硝酸反应生成二氧化碳,证明氮非金属性大于碳,饱和碳酸氢钠的作用是除去二氧化碳中硝酸蒸气,E中二氧化碳和硅酸钠反应,证明碳非金属性大于硅;
(2)稀硝酸具有挥发性,会干扰二氧化碳与硅酸的反应;
(3)硝酸能够置换出二氧化碳,二氧化碳能够与置换出硅酸,证明非金属性N>C>Si.
解答 解:(1)同周期自左而右,核电荷数增大,原子半径减小,原子核对电子吸引增强,失去电子能力减弱,获得电子的能力增强,故同周期从左到右,金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的金属性逐渐增强,非金属性逐渐减弱,C、N、Si三种非金属,C、N属于同一周期,C、Si属于同一主族,推知C、N、Si三种元素非金属性的强弱为N>C>Si,根据信息探究同周期、周主族元素的化学性质的变化规律,C、N属于同一周期,C、Si属于同一主族,C、N、Si三种非金属元素的非金属性强弱比较,B和C是碳酸钙和稀硝酸反应生成二氧化碳,证明氮非金属性大于碳,饱和碳酸氢钠的作用是除去二氧化碳中硝酸蒸气,E中二氧化碳和硅酸钠反应,证明碳非金属性大于硅,
故答案为:稀硝酸;大理石;饱和的小苏打溶液;水玻璃;
(2)由于稀硝酸具有挥发性,挥发出的硝酸能够与硅酸钠反应生成硅酸沉淀,干扰了二氧化碳与硅酸钠的反应,
故答案为:不可行;稀硝酸具有挥发性,干扰了二氧化碳与硅酸钠的反应;
(3)硝酸、碳酸和硅酸分别为N、C、Si元素的最高价氧化物对应的水合物,根据碳酸钙溶解可知硝酸的酸性大于碳酸,根据二氧化碳与硅酸钠反应生成沉淀可知碳酸的酸性大于硅酸,则C、N、Si三种元素非金属性N>C>Si,发生的反应有:2H++CaCO3═Ca2++CO2↑+H2O、SiO32-+CO2+H2O=H2SiO3↓+CO32-,
故答案为:酸性:HNO3>H2CO3>H2SiO3,则C、N、Si三种元素非金属性N>C>Si;2H++CaCO3═Ca2++CO2↑+H2O、SiO32-+CO2+H2O=H2SiO3↓+CO32-.
点评 本题考查了非金属性强弱判断的方法,题目难度中等,明确实验目的为解答关键,注意掌握同一主族、同一周期元素金属性、非金属性递变规律,试题培养了学生的分析能力及化学实验能力.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+→Ag+→H+ | B. | Ag+→Ba2+→H+ | C. | H+→Ba2+→Ag+ | D. | H+→Ag+→Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
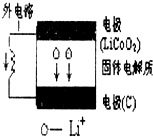
| A. | 电池内部“→”表示放电时Li+的迁移方向,外电路上的“→”表示放电时的电流方向 | |
| B. | 放电时负极的电极反应:LiCoO2-xe-═Li1-xCoO2+xLi+ | |
| C. | 充电时阴极的电极反应:6C+xLi++xe-═LixC6 | |
| D. | 当外电路有2 mole-通过,发生迁移的Li+的质量为7 g(Li的相对原子质量为 7) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
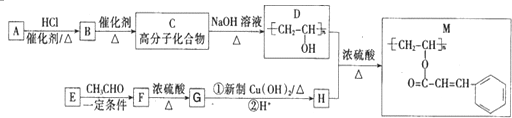
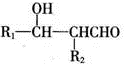
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入KSCN溶液,出现血红色,一定不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.6 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
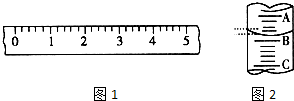 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com