
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO 3- NO 3- OH- |
分析 ①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有铜离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有铝离子,E中含有氢氧根离子;
③进行焰色反应实验,只有B、C含有钾离子,所以E是氢氧化钠;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有碳酸氢根离子,C、D中产生白色沉淀,则C、D中含有硫酸根离子,所以D是硫酸铜,C是硫酸铝钾;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是硝酸钾,所以A是碳酸氢钠,以此来解答.
解答 解:综上所述可知,A为NaHCO3,B为KNO3,C为KAl(SO4)2,D为CuSO4,E为NaOH,
(1)C、D的化学式分别为KAl(SO4)2、CuSO4,故答案为:KAl(SO4)2;CuSO4;
(2)含1mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物为碳酸钠,A与E反应的离子方程式为HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(3)A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O,
故答案为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O;
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理为Al3++3H2O?Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮物净水,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮物净水;
(5)含溶质0.5mol的C溶液中逐滴加入Ba(OH)2溶液,质量质量最大时生成硫酸钡和偏铝酸钾,由硫酸根离子守恒可知,生成硫酸钡为0.5mol×2×233g/mol=233g,
故答案为:233.
点评 本题考查无机物的推断,为高频考点,把握发生的反应、离子共存、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
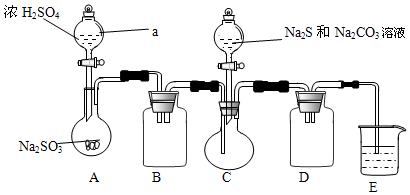
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
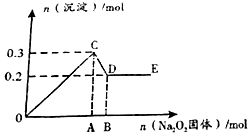 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
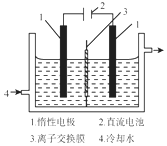 碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.| 试验方法 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
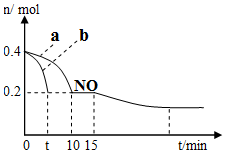 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
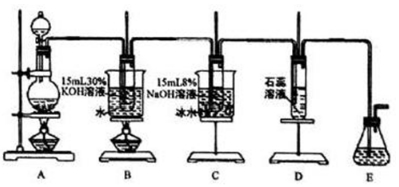
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ------------- |
| 步骤2: 向A试管中加入1-2mL 0.0lmol•L-1 KMnO4溶液,振荡试管 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
| 步骤3: 向B试管中滴加1-2滴淀粉-KI溶液 | (1)若溶液变蓝,则假设成立 (2)若溶液不变蓝,综合步骤中的(2),则假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
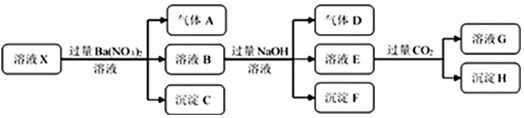
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100mL,产生的气体A为112mL(标况),则X中c(Fe2+)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=0.03mol•L-1•s-1 | B. | v(NO2)=0.7mol•L-1•min-1 | ||
| C. | v(N2)=0.4mol•L-1•min-1 | D. | v(CO2)=1.1mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com