
下列离子方程式正确的是( )
|
| A. | 向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉Fe+4H++N03﹣═Fe3++NO↑+2H2O |
|
| B. | 少量SO2通入Ca(ClO)2溶液中SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO |
|
| C. | 漂白粉溶液在空气中失效ClO﹣+CO2+H2O═HClO+HCO3﹣ |
|
| D. | Ba(OH)2溶液中滴加NaHSO4溶液至中性Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O |
| 离子方程式的书写.. | |
| 专题: | 离子反应专题. |
| 分析: | A.5.6g铁的物质的量为0.1mol,n(HNO3)=8mol/L×0.04L=0.32mol,n(Fe):n(HNO3)=5:16,因为< B.ClO﹣具有氧化性,可氧化SO2生成SO42﹣; C.漂白粉溶液与空气中反应生成CaCO3和HClO; D.Ba(OH)2溶液中滴加NaHSO4溶液至中性,反应生成硫酸钡、硫酸钠和水; |
| 解答: | 解:A.5.6g铁的物质的量为0.1mol,n(HNO3)=8mol/L×0.04L=0.32mol,n(Fe):n(HNO3)=5:16,因为< x+y=0.1 4x+y=0.32 解得:x=0.04 y=0.06 三价铁离子和二价铁离子的物质的量之比为0.04:0.06=2:3,所以离子方程式为5Fe+16H++6NO3﹣═2Fe3++2NO↑+8H2O+3Fe2++4NO2↑,故A错误; B.ClO﹣具有氧化性,可氧化SO2生成SO42﹣,则次氯酸钙溶液中通入少量SO2,发生Ca2++ClO﹣+SO2+H2O═CaSO4↓+Cl﹣+2H+,故B错误; C.漂白粉溶液在空气中失效,离子方程式为:漂白粉溶液与空气中反应生成CaCO3和HClO,反应的离子方程式为Ca2++2ClO﹣+CO2+H2O=CaCO3+2HClO,故C错误; D.Ba(OH)2溶液中滴加NaHSO4溶液至中性,离子方程式为:Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O,故D正确; 故选:D. |
| 点评: | 本题考查离子方程式的书写,熟悉反应的实质是解题关键,注意反应物用量对反应的影响,选项A为易错选项. |


科目:高中化学 来源: 题型:
用石灰水保存鲜蛋是一种化学保鲜法,石灰水能保存鲜蛋的原理是( )
①石灰水具有强碱性,杀菌能力强
②Ca(OH)2能与鲜蛋呼出的CO2反应,生成CaCO3薄膜,起保护作用
③石灰水是电解质溶液,能使蛋白质凝聚
④石灰水能渗入蛋内中和酸性物质
A.①② B.③④
C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是
A.0.5molNaCl溶解在1 L水中,所得溶液的物质的量浓度为0.5 mol/L
B.10mL 1 mol/L的硫酸溶液与100mL 0.1mol/L的硫酸溶液的物质的量浓度相同
C.1mol任何气体所含的气体分子数目都相等
D.1molCH4的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室要制取Cl22.24L (标况下)。(1)写出相应的化学方程式。(2)求出所需的MnO2质量和被氧化HCl在标况下的体积.(不考虑HCl的消耗)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 |
|
| B. | 向硅酸钠溶液中滴加盐酸,有白色凝胶生成 |
|
| C. | 向AlCl3溶液中逐滴滴加氨水至过量,先出现白色沉淀后溶解 |
|
| D. | 工业上可以电解氯化镁溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验.请回答下列问题:
(1)仪器a的名称为 ;仪器b中可选择的试剂为 .
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母).
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有 性,写出相应的化学方程式
(4)E装置中浓硫酸的作用 .
(5)读取气体体积前,应对装置F进行的操作:
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)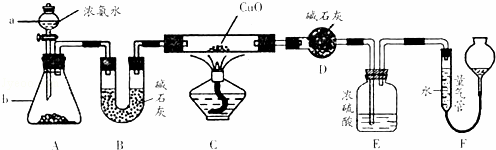
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaCl固体配制0.1 mol·L-1的NaCl溶液,下列操作或说法正确的是
A.若在移液过程中,溶液溅出容量瓶,则应重新配制溶液
B.将5.85gNaCl固体溶于1 L水中可配成0.1 mol·L-1的NaCl溶液
C.固体直接转移到容量瓶中,并加水稀释到刻度线
D.称量时,将固体NaCl直接放在天平左盘上
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某一容器共收集到1体积CO2、3体积H2,该容器中CO2 、H2的物质的量
之比是 ,若该容器收集的CO2、H2两种气体所含分子数相等,
则CO2、H2的质量比是 。
(2)44gM和49gN恰好完全反应生成76gB和一定量的气体F,若F的相对分子质量为34。则标准状况下F的体积 。
(3)A是二价金属,其硝酸盐的电离方程式为 ,82g该盐中含有
6.02×1023个硝酸根离子,则该硝酸盐的摩尔质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里常利用反应:3Cu+8HNO3(稀)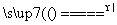 3Cu(NO3)2+2NO↑+4H2O来制取NO,当有6.4 g Cu参加反应时,计算:
3Cu(NO3)2+2NO↑+4H2O来制取NO,当有6.4 g Cu参加反应时,计算:
(1)能生成多少升NO(标准状况下)?
(2)消耗多少摩尔HNO3?
(3)被还原的HNO3的物质的量为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com