
【题目】把铝粉和四氧化三铁粉末配成铝热剂并分成两等份,前一份在高温下恰好完全反应,将生成物与足量的盐酸充分反应;后一份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是
A.1:1B.3:4C.9:8D.4:3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,由这四种元素形成的一种盐溶液,遇到FeCl3溶液呈现血红色,该盐溶液与NaOH在加热条件下会生成一种能使湿润的红色石蕊试纸变蓝的气体。下列说法正确的是( )
A.W和X形成的化合物在常温下均为气态
B.X元素可以形成多种具有广泛用途的单质
C.X和Z的最高价氧化物对应水化物都是强酸
D.Y的简单离子与Z的简单离子具有相同的电子层结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强电解质溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究铁被海水腐蚀的实验装置。图2中M是某种与铁片紧贴的金属,下列说法正确的是

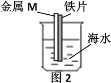
A.图1铁片靠近烧杯底部的部分,腐蚀更严重
B.若M是锌片,可保护铁
C.若M是铜片,可保护铁
D.M是铜或是锌都不能保护铁,是因没有构成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法均正确的一组是
选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
A | Cl2(H2O) | 饱和NaCl溶液 | 洗气 |
B | CH3CH2OH(H2O) | CaO | 蒸馏 |
C | FeCl2(FeCl3) | Cu | 过滤 |
D |
| CCl4 | 萃取 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )

A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于温水(40℃~80℃)、乙醇、乙酸乙酯,难溶于氯仿(氯仿通常是无色液体,不溶于水,密度约为水的1.5倍)。某实验小组设计如图实验流程从茶叶中提取茶多酚:
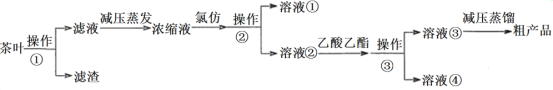
请回答下列问题:
(1)①将茶叶粉碎的目的是____________。
②用水浸取茶多酚时,实验小组发现搅拌速度越快,茶多酚浸出率下降,可能原因是_______。
(2)下列有关实验基本操作正确的是________。
A.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
B.分液漏斗使用前须检验是否漏水并洗净备用
C.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
D.操作③分液时,溶液④应该从分液漏斗下口放出
(3)采用减压蒸发的理由是____________。
(4)溶液①在分液漏斗的_______(填“上”或“下”)层。
(5)为了进一步对粗产品进行提纯,可以采用的提纯方法是_____________。
(6)在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
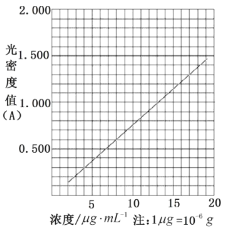
称取2.00g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00 mL,加过量Fe3+和K3Fe(CN)6酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值A=1.200,经过计算产品的纯度是_______(以质量分数表示,保留至小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com