
����Ŀ����1���ȼҵ�е�ⱥ��ʳ��ˮ��ԭ��ʾ��ͼ����ͼ��ʾ��

��ҺA������������__________����ⱥ��ʳ��ˮ�����ӷ���ʽΪ___________��
��2��������һ�������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
��֪��CH4(g)��H2O(g)��CO(g)��3H2(g) ��H��+206.2 kJ/mol
CH4(g)��CO2(g)��2CO(g)��2H2(g) ��H��+247.4 kJ/mol
�Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ_________________��
��3����������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӡ�N4���ӽṹ��ͼ����֪����1mol N��N����167kJ����������1mol N��N�ų�942kJ����������������Ϣ�����ݣ�����N2��������1mol��̬N4�ġ�H=_____kJ/mol��

��4����COΪȼ����������ȼ�ϵ�أ���ص�����ͨ��O2��CO2������ͨ��CO�������������Na2CO3�����ظ����缫��ӦʽΪ_______________�������ĵ缫��ӦʽΪ ____________���ŵ�ʱ��CO32�� �����ص�_______(���������)����
���𰸡� �������� 2Cl-+2H2O![]() 2OH-+H2��+Cl2�� CH4(g)��2H2O(g) ��CO2(g) ��4H2(g) ��H��+165.0 kJ/mol +882 kJ/mol CO+CO32--2e-=2CO2 O2+2CO2+4e-=2CO32- ��
2OH-+H2��+Cl2�� CH4(g)��2H2O(g) ��CO2(g) ��4H2(g) ��H��+165.0 kJ/mol +882 kJ/mol CO+CO32--2e-=2CO2 O2+2CO2+4e-=2CO32- ��
����������1���Ҳ�缫���������������ӷŵ磬ˮ�ĵ���ƽ�ⱻ�ƻ���ͬʱ�����������ƣ�����ҺA�������������������ƣ���ⱥ��ʳ��ˮ�����ӷ���ʽΪ2Cl-+2H2O![]() 2OH-+H2��+Cl2����
2OH-+H2��+Cl2����
��2����֪��
��CH4(g)��H2O(g)��CO(g)��3H2(g) ��H��+206.2 kJ/mol
��CH4(g)��CO2(g)��2CO(g)��2H2(g) ��H��+247.4 kJ/mol
���ݸ�˹���ɿ�֪�١�2���ڼ��õ�CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪCH4(g)��2H2O(g)��CO2(g)��4H2(g) ��H��+165.0 kJ/mol��
��3��N2��������1mol��̬N4�Ļ�ѧ����ʽΪ2N2��N4������ݷ�Ӧ�ȵ��ڶϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ��֪��H��942kJ/mol��2��167kJ/mol��6��+882 kJ/mol��
��4����������ʧȥ���ӵ�������Ӧ����CO�ڸ����ŵ磬���������ڵ�̼����Ϊ����ʣ����ظ����缫��ӦʽΪCO+CO32--2e-��2CO2�����������õ����ӣ��缫��ӦʽΪO2+2CO2+4e-��2CO32-��ԭ��������������ƶ�����ŵ�ʱ��CO32�� �����صĸ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʳ��ά���е�ͻ���������ܣ��������ܵ����ǵ��ձ��ע��������������֯��Ϊ����ġ�����Ӫ���ء���ľ������һ�ַ�������ʳ��ά���䵥��֮һ�ǽ��Ӵ����ṹ��ͼ��ʾ�������йؽ��Ӵ���˵����ȷ���ǣ� �� 
A.���Ӵ��ķ���ʽ��C11H12O4
B.���Ӵ�����������̼ԭ�ӿ�����ͬһƽ��
C.1mol���Ӵ�����������ˮ��Ӧ����3molBr2
D.1mol���Ӵ���������������Ӧ��������4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������Ҫ����Al2O3��Al��OH��3��AlO��OH����������Fe2O3�����ʣ����ðݶ���������������������ͼ��ʾ��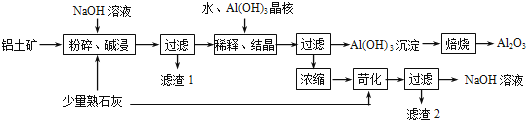
��1����������������ʱӦ�ڸ����½��У���Ŀ���� ��
��2��AlO��OH����NaOH��Ӧ�Ļ�ѧ����ʽΪ�� ��
��3����ϡ�͡��ᾧ�����У�ϡ�͵�Ŀ���� ����Al��OH��3���˵�Ŀ���Ǵٽ�Al��OH��3��������������ϡ�͡��ᾧ�����գ�Ҳ����ͨ�������� ����ķ��������森
��4��Ũ�����õ�NaOH��Һ���������˿����е�CO2���������ʣ������ʿ�ͨ��������Ӧ��ȥ��д��������Ӧ�Ļ�ѧ����ʽ���� ��
��5��������������ʵ�� ���ѧʽ����ѭ�����ã�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������������Ӧ�������ɣ�CH3��2CHCH2CH3 �� ������������ǣ� ��
A.2������2����ϩ
B.3������1����ϩ
C.2��3��������1����ϩ
D.2������1��3������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ���֮�������ͼ��ʾ��ת����ϵ����ײ������ǣ� ��
�� ![]() ��
�� ![]() ����
����
A.N2
B.C
C.Mg
D.Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�����ǵ��͵Ŀɳ���أ��������Ƕ��Բ��ϣ�����ܷ�ӦʽΪ��Pb��PbO2��2H2SO4![]() 2PbSO4��2H2O���ش���������(�������⡢����������ԭ)��
2PbSO4��2H2O���ش���������(�������⡢����������ԭ)��
��1���ŵ�ʱ�������ĵ缫��Ӧʽ��________________�������·ͨ��2 mol����ʱ�������ϸ��������������______������������������ʵ���Ϊ______��
��2������ȫ�ŵ�ľ�PbO2��Pbʱ��������ͼ���ӣ����һ��ʱ�������A�缫������____________����ʱǦ���ص��������ļ��Խ�___________��������䡱�Ի�����

��3������Ǧ���ص����NaCl��CuSO4��ɵĻ����Һ������c��Na+��=3c��Cu2+��=0.3 mol��L-1��ȡ�û��Һ100 mL����ʯī���缫���е�⣬ͨ��һ��ʱ����������ռ���0.112 L����״�������壬��Ǧ������ת�Ƶ��ӵ����ʵ���Ϊ_______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Na2S2O3������Ϊ���ȼ�����֪25.0 mL 0.100 mol��L-1 Na2S2O3��Һǡ�ð�224 mL Cl2����״��������ȫת��ΪCl������S2O32����ת��Ϊ�� ��
A. SO42�� B. S C. SO32�� D. S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ͼ��ʾװ����ȡ�������������Իش��������⣺ 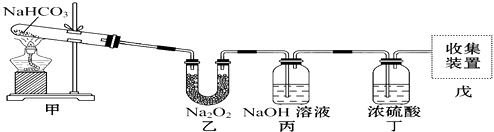
��1�����з����ķ�Ӧ�Ļ�ѧ����ʽΪ��������Na2O2���ܷ����ķ�Ӧ�У�д��ѧ����ʽ��
��2������NaOH��Һ�������� �� ����Ũ����������� ��
��3������ԭװ������˳���Ϊ�ס����������ҡ��죬����װ�������ܷ��ռ�������������ܡ����ܡ�����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�ͳ�в�ҩ���˵���Ч�ɷ�֮һ��������ϸ����ɱ���ж������ã������йغ������ص�������ȷ���ǣ�������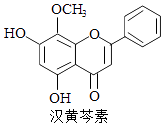
A.�������صķ���ʽΪC16H13O5
B.��������FeCl3��Һ��ɫ
C.1 mol����������ˮ��Ӧ���������1mol Br2
D.������H2�����ӳɷ�Ӧ�÷����й����ŵ��������1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com