
| A. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 | |
| B. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3 COO -) | |
| C. | 在氯水中通入氯化氢气体后,溶液中c(HClO)减小 | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.醋酸稀释后醋酸的电离程度增大,但氢离子浓度减小,溶液的pH增大;
B.当溶液呈中性时,根据电荷守恒可知钠离子与醋酸根离子浓度相等;
C.氯水中存在溶解平衡Cl2+H2O?HClO+HCl,HCl浓度增大,平衡向着逆向移动;
D.氨水为弱碱,混合液中氨水过量,溶液呈碱性,则c(OH-)>c(H+).
解答 解:A.醋酸浓度越小,其电离程度越大,则稀醋酸加水稀释后醋酸电离程度增大,由于氢离子浓度减小,则溶液的pH升高,故A正确;
B.在CH3COONa溶液中加入适量CH3COOH,当溶液为中性时,c(OH-)=c(H+),根据电荷守恒可知:c(Na+)=c(CH3 COO-),故B正确;
C.在氯水中通入氯化氢气体后,溶解平衡Cl2+H2O?HClO+HCl向着逆向移动,导致溶液中c(HClO)减小,故C正确;
D.氨水为弱碱,常温下pH=2的盐酸与pH=12的氨水等体积混合后溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知c(NH4+)>c(Cl-),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选D.
点评 本题考查较为综合,涉及离子浓度大小比较、弱电解质的电离平衡、氯水溶解平衡及其影响,注意掌握化学平衡及其影响,试题培养了学生的分析能力及综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管量取10.15 mL KMnO4溶液 | |
| B. | 在FeBr3溶液中通入Cl2以除去其中FeCl2杂质 | |
| C. | 用FeCl3溶液检验KC1中是否含有KSCN杂质 | |
| D. | 常温下将铝片和铜片分别放入浓硝酸中以证明铝比铜活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO+2H+═Cu2++H2O | B. | CaCO3+2H+═Ca2++CO2↑+H2O | ||
| C. | Fe+2H+═Fe2++H2↑ | D. | Ba(OH)2+2H+═Ba2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
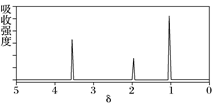
| A. | 若A的分子式为C3H6O2,则其结构简式为CH3COOCH3 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3 | |
| C. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C3H6O2,则其同分异构体有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| B. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| C. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| D. | 在标准状态下等质量的甲烷和氧气的体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手持试管给试管内的物质加热 | |
| B. | 用燃着的酒精灯去点燃另一盏酒精灯 | |
| C. | 用天平称量药品时用手直接拿砝码 | |
| D. | 蒸馏操作时冷凝管中冷却水应该从下方通入,从上方流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所得电荷数SO42-是Na+的0.4倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置中阴极上析出红色固体 | |
| B. | 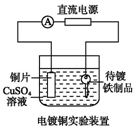 装置的待镀铁制品应与电源负极相连 | |
| C. | 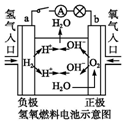 装置闭合电键后,外电路电子由a极流向b极 | |
| D. | 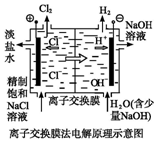 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com