
【题目】将W1g光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2g。实验时由于所伸入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
A.NaOH溶液,W1=W2B.NaHSO4溶液,W1<W2
C.无水乙醇,W1=W2D.CO,W1>W2
【答案】C
【解析】
光亮的铜丝在空气中加热时,铜丝和氧气反应2Cu+O2![]() 2CuO生成黑色的氧化铜,所以加热后的铜丝质量会增加。
2CuO生成黑色的氧化铜,所以加热后的铜丝质量会增加。
A.NaOH溶液和CuO不反应,所以W2g为氧化铜的质量,W1g为铜丝的质量,所以W1<W2,故A错误;
B.2NaHSO4+CuO=CuSO4+Na2SO4+H2O,硫酸氢钠和氧化铜反应生成硫酸铜,所以有部分铜元素以离子方式进入溶液,W2g为未被氧化的铜质量,所以W1>W2,故B错误;
C.CH3CH2OH+CuO![]() CH3CHO+Cu+H2O,固体氧化铜又生成铜,所以W2g为铜的质量,W1g为铜的质量,所以W1=W2,故C正确;
CH3CHO+Cu+H2O,固体氧化铜又生成铜,所以W2g为铜的质量,W1g为铜的质量,所以W1=W2,故C正确;
D.氧化铜和CO反应生成固体铜,所以W2g为铜的质量,W1g为铜的质量,所以W1=W2,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
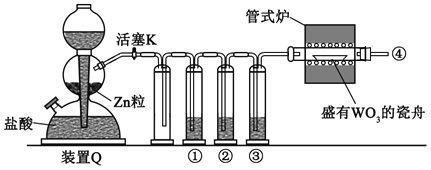
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含锌废渣及粉尘是危险废物,碱浸电解法处理可得锌粉。但若其中存在氯,则锌质量就严重下降,对电极板也有严重腐蚀作用。工业上模拟碱浸电解法处理含锌质量分数为16%的废料(主要成分为ZnO、Zn(OH)2、ZnSO4及PbCO3、Fe2O3、Cu杂质)工艺如图:
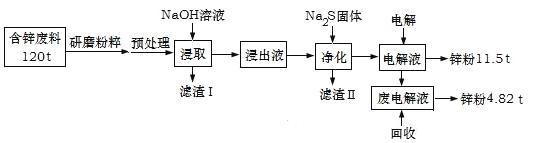
ⅰ.浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等离子
ⅱ.滤渣Ⅱ的主要成分为:Na2Pb(OH)xS![]()
(1)从物质分类的角度看,ZnO属于__,其与NaOH溶液发生反应的离子方程式为__。
(2)“滤渣Ⅰ”的主要成分为___。
(3)下表是“预处理”的2种除氯方案中粉尘氯的去除率和锌损失率分析表格可知,首选的“除氯剂”为___,原因是____。
除氯剂 | 碱(NaOH) | 碳酸钠 |
氯去除率/% | 78.75 | 83.69 |
锌损失率/% | 0.26 | 0.28 |
价格/t | 7200元 | 3600元 |
(4)“电解”过程中阴极的电极反应式为____。
(5)锌的总回收率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“502”胶水的主要成分为![]() ,下列说法错误的是( )
,下列说法错误的是( )
A. 该物质的分子式为C5H5NO2
B. 该物质难溶于水,易溶于苯等有机溶剂
C. 该物质可使酸性高锰酸钾溶液褪色
D. 该物质可经缩聚反应固化粘着
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为________________________。
(2)已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
Ⅱ.已知水的电离平衡曲线如图所示,试回答下列问题:
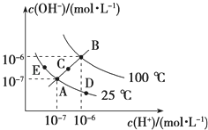
(3)图中五点KW间的关系是__________________.
(4)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(5)E对应的温度下,在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:________,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池成本低、安全性好,有望在未来取代锂离子电池,某新型可充电钠离子电池放电的工作原理如图所示。下列分析错误的是( )
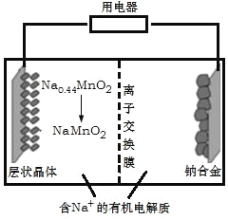
A. 出于环保考虑,应尽量避免使用重金属(如Pb)作为钠的合金化元素
B. 放电时,Na+由右室移向左室
C. 放电时,正极反应式为:Na0.44MnO2+0.56e-+0.56Na+=NaMnO2
D. 充电时,阴极质量变化4.6g时,外电路中通过0.1mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生反应的总化学方程式:2Fe+2H2O+O2=2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图所示。下列说法正确的是
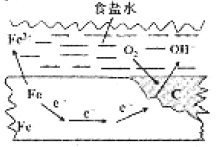
A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀生成的铁锈可以保护内层的铁不被腐蚀
C. 铁片腐蚀过程中负极发生的电极反应:2H2O+O2+4e-=4OH-
D. 铁片里的铁和碳与食盐水形成了无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com