
分析 (1)被还原的硝酸的物质的量等于气体的物质的量,根据n=$\frac{V}{{V}_{m}}$进行计算;
(2)Mg、Cu在反应中失去电子,最终生成Mg(OH)2、Cu(OH)2,则可知失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,由此分析解答;
(3)当金属离子全部沉淀时溶液为单一的硝酸钠溶液,根据组成n(NaOH)=0.5L×4mol/L-0.6mol=1.4mol,根据V=$\frac{n}{c}$计算.
解答 解:(1)被还原的硝酸的物质的量等于气体的物质的量,根据n=$\frac{V}{{V}_{m}}$=$\frac{13.44L}{22.4L/mol}$=0.6mol,答:被还原的硝酸的物质的量为0.6mol;
(2)Mg、Cu在反应中失去电子,最终生成Mg(OH)2、Cu(OH)2,则可知失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,所以结合氢氧根离子的物质的量为:$\frac{46.8g-26.4g}{17g/mol}$=1.2mol,设铜镁的物质的量分别为xmol和ymol,则64x+24y=26.4g,根据电子守恒为:2(x+y)=1.2mol,解之得:x=0.3mol,y=0.3mol,答:Mg的物质的量0.3mol;
(3)当金属离子全部沉淀时溶液为单一的硝酸钠溶液,根据组成n(NaOH)=0.5L×4mol/L-0.6mol=1.4mol,根据V=$\frac{n}{c}$=$\frac{1.4mol}{2mol/L}$=0.7L,答:当金属离子全部沉淀时所消耗NaOH溶液的体积为0.7L.
点评 本题考查混合物的计算,题目难度中等,本题注意把握电子转移的数目和氢氧根离子之间的关系,为解答该题的关键.


科目:高中化学 来源: 题型:解答题
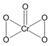 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.
雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.| 离子 | Na+ | K+ | NH4+ | NO3- | SO42- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 5×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si投入NaOH溶液中 Si+2OH-═SiO32-+H2 | |
| B. | 把 Al中投入到少量氢氧化钠溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾溶液中加入氢氧化钡溶液,恰好使“SO42-”完全沉淀 Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Na[Al(OH)4]溶液中加入过量CO2[Al(OH)4]-+CO2═HCO3-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.
T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃与60℃时,水的pH相等 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| C. | 常温,在0.10mol/L的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液pH值减小 | |
| D. | 向沸水中加入适量饱和的FeCl3溶液,可形成带电的胶体,其导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中一定不含金属元素 | |
| B. | 分子晶体中一定不含离子 | |
| C. | 金属离子一定满足最外层电子数为2或8 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| C. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y 的最低负化合价为一2,则Z的最高正化合价为+7 | |
| D. | 若X 的最高正化合价为十5,则五种元素一定都是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com