
| c(x)?c2(y) |
| c3(z)?c2(w) |
| A、升高温度,该反应平衡常数K的变化无法判断 |
| B、增大压强,W的质量分数减小 |
| C、该反应的化学方程式为:2z(g)+2w(g)?x(g)+2y(g) |
| D、增大X气体浓度平衡向正反应方向移动 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省忻州一中高一下学期第一次月考化学试卷(带解析) 题型:填空题
(14分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况完成下列问题:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的电子式是_________;生成的固体C的电子式是________________。
②若合成A是人工固氮的重要途径,试写出Y+X→A(气)的化学方程式______________。已知该反应为放热反应,则反应物所具有的总能量 生成物所具有总能量(填>、<或=)。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①A的结构式是_____________;
②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是_____________ ;
③将B与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的离子方程式是
_______________。
查看答案和解析>>
科目:高中化学 来源:2014届江苏省扬州市高二下学期期末调研测试化学试卷(解析版) 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
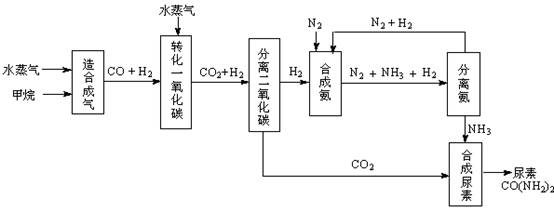
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一下学期第一次月考化学试卷(解析版) 题型:填空题
(14分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况完成下列问题:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的电子式是_________;生成的固体C的电子式是________________。
②若合成A是人工固氮的重要途径,试写出Y+X→A(气)的化学方程式______________。已知该反应为放热反应,则反应物所具有的总能量 生成物所具有总能量(填>、<或=)。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①A的结构式是_____________;
②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是_____________ ;
③将B与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的离子方程式是
_______________。
查看答案和解析>>
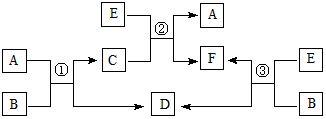
科目:高中化学 来源:0127 模拟题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com