
(Ⅰ)根据反应4HCl(浓)+MnO2  MnCl2+Cl2↑+2H2O回答下列问题:
MnCl2+Cl2↑+2H2O回答下列问题:
(1)氧化剂是 , 氧化产物是 。
(2)HCl(浓)的作用是 。
(3)当有4mol HCl被氧化时,氧化产物的物质的量为 ,反应中转移的电子数为 。
(Ⅱ)丹砂的成分是HgS,汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
反应Ⅰ:HgS+O2  Hg+SO2
Hg+SO2
反应Ⅱ:4HgS+4CaO  4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
(1)反应Ⅰ中,还原产物是________,每生成1molSO2分子,转移电子数为________。
(2)反应Ⅱ中,HgS是________(填“氧化剂”、“还原剂”),用双线桥法标出反应Ⅱ中电子转移的方向和数目 。
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子。
(1)C的元素符号是 ;元素F在周期表中的位置 。
 (2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
(2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
(3)C4气态分子结构如图所示,已知断裂1molC-C吸收l67KJ的热量,
生成lmol C C放出942KJ热量。试写出由C4气态分子变成C2气态分
C放出942KJ热量。试写出由C4气态分子变成C2气态分
子的热化学方程式 。
(4)某盐x (C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分
步水解而呈弱酸性。
① 盐x显酸性原因(用离子方程式表示) 。
② 写出足量金属镁加入盐x的溶液中所发生反应的化学方程式
。
(5)E所在周期中原子半径最大的元素与D元素可形成化合物у,酚酞试液遇у先变红后褪色,写出等物质的量的у与FeSO4投入水中恰好完全反应的离子反应方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是
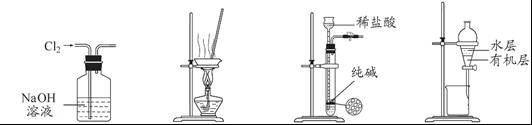

图1 图2 图3 图4
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应3S+6KOH 加热 K2SO3+2K2S+3H2O中,还原剂和氧化剂的物质的量比为( )
A.1 :1 B.2 :1 C.1 :2 D.3 :2
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下列材料,选择将乙二醇和丙三醇的混合物分离的适宜方法是( )
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 与水和酒精等混溶 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 与水和酒精等混溶 |
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤” 的方法 D.分液法
查看答案和解析>>
科目:高中化学 来源: 题型:
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO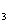 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物 B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H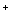 D. 该药剂不适合于胃溃疡患者服用
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.18 g水含有的电子数为9 NA
B.46g NO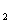 和N2O4的混合物中所含氮原子个数为6.02×10
和N2O4的混合物中所含氮原子个数为6.02×10
C.0.1mol过氧化钠与足量的水反应,转移的电子数为 0.2NA
D.1L 0.3 mol/LNa2SO4溶液中,含有Na+和SO42- 总数为0.6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质漂白的叙述中正确的是( )
A.氯水中通入一定量二氧化硫气体可增强氯水的漂白性
B.含有酚酞的氢氧化钠溶液中通入二氧化硫气体,溶液变无色,说明二氧化硫具有漂白性
C.漂白粉是混合物,其有效成分是次氯酸钙,漂白精是纯净物,其成分也是次氯酸钙
D.漂白粉放入稀酸中可以提高漂白速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是________________。
A.铝材 B.石墨 C.铅板 D.纯铝
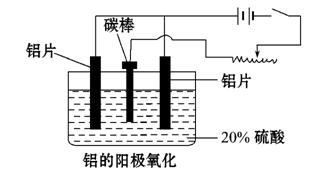 (3)阳极氧化能使金属表面生成
(3)阳极氧化能使金属表面生成
致密的氧化膜。以稀硫酸为电解液,铝
阳极发生的电极反应式为
__________________________________。
(4)在铝阳极氧化过程中,需要不断
地调整电压,理由是____________ ___
。
(5)下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com