
向下图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液退色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是
A | B | C | D | NO2 | HCl | SO2[来 | |
Y | Na2SO3溶液 | 水 | Na2SO3溶液 | 饱和NaHCO3溶液 |
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是
A.H2SO4 B.HCl C.NaOH D.NaNO3
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
标准状况下,向1 00 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是
00 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是

A. b点水的电离程度比c点水的电离程度大
B.氢硫酸的酸性比亚硫酸的酸性强
C.原H2S溶液的物质的量浓度为0.05 mol·L-1
D.a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化(其中m≠n,且均为正整数)。下列说法正确的是
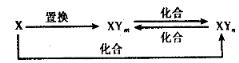
A.X一定为非金属元素 B.X、Y可能均为非金属元素
C.若X为Fe,Y可为Cl、Br和I D.若X为Fe,Y只能为Cl
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
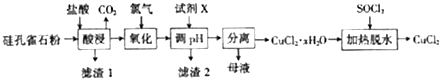
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 或
或 .
.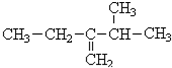 2-乙基-3-甲基-1-丁烯;
2-乙基-3-甲基-1-丁烯;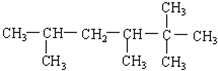 2,2,3,5-四甲基己烷.
2,2,3,5-四甲基己烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验所用试剂或操作 | 实 验 现 象 | 验证的性质 |
| 碘化钾淀粉溶液 | ||
| 取适量过氧化氢溶液于试管中,加热,用带火星的木条检验. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com