下列说法正确的是( )
A.使用催化剂可以改变化学反应的反应热
B.在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.向饱和AgCl水溶液中加入盐酸,溶液中c(Ag+)?c (Cl-)的值变大
D.升高Na2CO3溶液的温度,溶液中c(HCO3-)/c(CO32-)减小
【答案】分析:A.催化剂可以改变化学反应正反应和逆反应的活化能,但不能改变反应热;
B.Mg(OH)2电离出来的OH-与NH4+结合生成弱电解质NH3?H2O,从而促进Mg(OH)2的溶解;
C.根据溶度积KSP=c(Ag+)?c (Cl-)只与温度有关;
D.升高温度,促进碳酸根离子水解;
解答:解:A.催化剂可以改变化学反应正反应和逆反应的活化能,但不能改变反应热,所以使用催化剂不可以改变化学反应的反应热,故A错误;
B.Mg(OH)2溶液中存在溶解平衡Mg(OH)2?Mg 2++2OH-,Mg(OH)2电离出来的OH-与NH4+结合生成难电离的弱电解质NH3?H2O,氢氧根离子浓度降低,从而使Mg(OH)2的溶解平衡向右移动,促进氢氧化镁溶解,镁离子浓度增大,故B正确;
C.饱和AgCl水溶液中存在溶解平衡AgCl?Ag++Cl-,加入盐酸,c (Cl-)的值变大,平衡逆向移动,但温度不变,所以c(Ag+)?c (Cl-)的值不变,故C错误;
D.温度升高,水解是吸热反应,平衡向着正反应方向移动,c(HCO3-)增大,c(CO32-)减小,所以c(HCO3-)/c(CO32-)比值变大,故D错误;
故选:B.
点评:本题考查了催化剂、水解平衡,难溶电解质的溶解平衡,从平衡角度进行分析解答即可,难度不大.




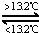 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,