
(12分)O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为__________,原子个数比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为____ ,原子个数比为______,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________ (用含NA的式子表示)。
(1)3:2 1:1 (2)1:1 2:3 2:3 (3)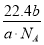 L
L
【解析】
试题分析:(1)设其质量为m,等质量的O2和O3所含分子个数比=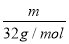 NA:
NA: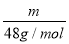 NA=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1;
NA=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1;
(2)温同压下,气体摩尔体积相同,根据N=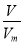 NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=
NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=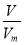 M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
(3)氧气的摩尔质量为M=m÷n= g/mol,则c g O2在标准状况下体积为:V=
g/mol,则c g O2在标准状况下体积为:V=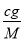 ?Vm=
?Vm=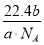 L。
L。
考点:考查常用化学计量数计算、阿伏伽德罗定律及推论


科目:高中化学 来源:2015届山东省高三10月阶段性考试化学试卷(解析版) 题型:选择题
在反应3Cl2 + 8NH3 → 6NH4Cl + N2中,设阿伏加德罗常数为NA。则下列说法正确的是( )
A.若有0.3 mol Cl2参加反应,转移的电子数为0.6NA
B.若生成2.24 L氮气,转移的电子数为0.6NA
C.若有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g
D.若生成1 mol的氯化铵转移电子数是n个,则NA=1/n
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高三10月阶段测试化学试卷(解析版) 题型:选择题
关于物质的分类正确的是( )
A.SO2、CO2、CO、NO2都是酸性氧化物
B.Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物
C.HCl、HClO、HNO3、HClO4都是强酸
D.NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱
查看答案和解析>>
科目:高中化学 来源:2015届山东省泰安市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关化学用语使用正确的是
A.硫原子的原子结构示意图: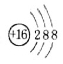
B.NH4Cl的电子式: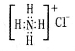
C.核内有8个中子的碳原子: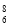 C
C
D.HCO3-电离的离子方程式:HCO3-+H2O CO32-+H3O+
CO32-+H3O+
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
下列关于铝的叙述中正确的是
A.铝合金是一种混合物,它比纯铝的熔点高
B.由于铝的导电性比铜、银都强,所以常用其制造电线、电缆
C.由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属
D.常温下,由于铝与浓硫酸钝化时不反应,所以可用铝制槽车运送浓硫酸
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是 ( )
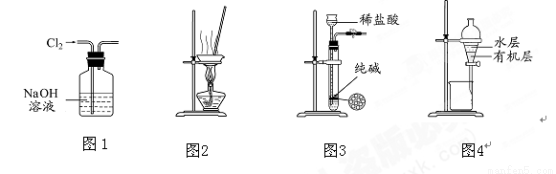
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO 、S2-、SO
、S2-、SO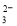
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:实验题
(18分)按要求回答下列问题
(1)某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
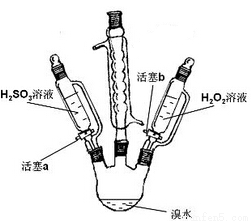
①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,该反应的离子方程式为________,得出的结论是:H2SO3的氧化性比Br2的氧化性______(填“强”或“弱”)。
②再打开活塞b,向所得溶液中逐滴加入H2O2,刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色,变橙黄色反应的离子方程式为_____________________________,得出的结论是H2O2的氧化性比Br2的氧化性____(填“强”或“弱”)。
(2)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,为了清楚沉淀的物质,研究小组向试管中加入过量稀盐酸,沉淀不溶解,你认为沉淀物是____________,产生该物质可能的原因是________________________。
(3)为探究SO2使品红溶液褪色的原因,该小组同学将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,由此所得出的结论正确的是__________(填编号)。
a.SO2使品红溶液褪色的微粒一定不是SO2分子
b.SO2使品红溶液褪色的微粒一定是H2SO3分子
c.此实验无法确定SO2使品红溶液褪色的微粒
d.将干燥的SO2气体通入品红的酒精溶液中,能使品红褪色由此可猜想使品红溶液褪色的微粒可能是___________________________。
(4)配平并完成下列离子方程式___MnO4-+___H2O2+___ ____=__Mn2++__O2+__H2O每有1mol高锰酸根参加反应,生成_______mol O2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com